Índice
Te explicamos qué es el estado gaseoso y las propiedades físicas y químicas que presenta. Además, sus características y ejemplos.

¿Qué es el estado gaseoso?
El estado gaseoso es uno de los estados de agregación de la materia, junto a los estados sólido, líquido y plasmático. La materia en estado gaseoso se denomina “gas”. Se caracteriza por estar compuesta por sus partículas muy poco unidas entre sí.
Las partículas de las sustancias en estado gaseoso tienen muy poca fuerza de atracción entre sí, por lo que se expanden a lo largo y ancho del contenedor en el que se encuentran y se adaptan a su forma. Esto se debe a que vibran con mucha mayor energía y velocidad que en los líquidos o los sólidos.
Debido a esta cohesión (fuerzas que unen a las partículas) casi nula que tienen las partículas de los gases, estos poseen una enorme capacidad para ser comprimidos. La compresión es un proceso que industrialmente se utiliza para licuar los gases, de esta forma ocupan un menor volumen y se hace más fácil transportarlos.
Origen del nombre gas
El término “gas” fue acuñado por el científico de origen flamenco Jan Baptista van Helmont, en el siglo XVII.
Proviene del término latino chaos (“caos”), pues el estado observable de las partículas de un gas tiende a la dispersión y a un aparente desorden.
En comparación con los sólidos y los líquidos, el gaseoso es el estado de la materia más caótico.
Diferencia entre gas y vapor
El vapor es un gas que, cuando se comprime lo suficiente a temperatura constante, se transforma en líquido. El gas, por el contrario, no puede transformarse en líquido en estas condiciones.
Propiedades físicas de los gases

Los gases presentan las siguientes propiedades físicas:
- No tienen forma definida, por lo que adoptan la forma del recipiente en que están contenidos.
- No tienen volumen definido, así que tienden a copar todo el volumen del espacio donde se encuentren.
- Son altamente compresibles, es decir, dado el enorme espacio entre sus partículas, se los puede obligar a ocupar un volumen más pequeño.
- Los gases son fluidos, al igual que los líquidos, y pueden desplazarse con poca fricción desde un envase hacia otro.
- Las partículas de los gases están tan alejadas entre sí que su peso total es menor y son menos afectadas por la gravedad, por lo que pueden permanecer en suspensión en la atmósfera.
- Los gases pueden ser más o menos densos que el aire (dependiendo de su naturaleza), es decir, pueden elevarse o caer una vez que son liberados a la atmósfera.
- El sabor, olor y color de los gases depende de los elementos químicos que los conforman.
- Los gases se difunden con rapidez en el vacío o entre otros gases.
Propiedades químicas de los gases
Los átomos y moléculas de un gas se hallan alejadas entre sí y movilizándose a niveles de energía muy elevados. Por eso, resulta imposible que permanezcan juntas y rígidas como en el caso de los sólidos.
El estado de agregación de la materia no altera las propiedades químicas de las sustancias que la componen. Por lo tanto, la naturaleza química de los gases puede variar enormemente: algunos pueden ser inertes, otros inflamables, corrosivos o tóxicos, dependiendo de la reactividad química de sus elementos.
Ley general de los gases
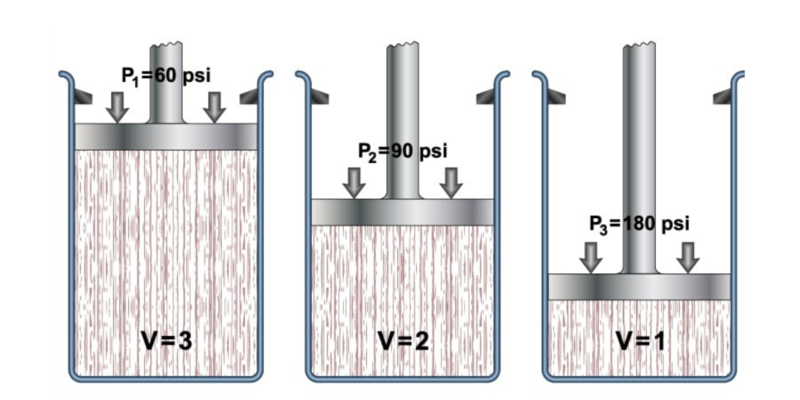
La ley general de los gases describe el comportamiento general de los gases, combinando un conjunto de leyes más específicas como la Ley de Boyle-Mariotte, la Ley de Charles y la Ley de Gay-Lussac. Todas ellas se refieren al comportamiento de la presión, el volumen y la temperatura de los gases.
- Ley de Boyle-Mariotte. También llamada ley de Boyle, formulada por Robert Boyle y Edme Marotte, relaciona la presión y el volumen de un gas con su temperatura, de modo que si la temperatura es constante, pueden determinarse las demás propiedades. Esto se expresa como:
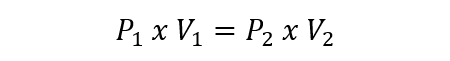
- Ley de Charles. Esta ley propone que a una presión dada, el volumen ocupado por una cantidad constante de gas es directamente proporcional a su temperatura expresada en kelvin. Esto se expresa así:
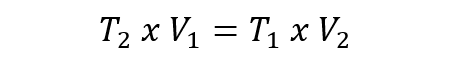
- Ley de Gay-Lussac. Esta ley expresa que dada una cantidad determinada y constante de gas, su presión será directamente proporcional a su temperatura expresada en kelvin, siempre que el volumen se mantenga constante. Esto se expresa así:
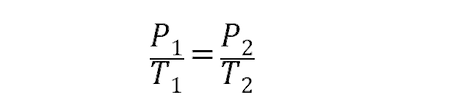
En todas las ecuaciones anteriores V1, P1 y T1 son el volumen, la presión y la temperatura inicial. Mientras que V2, P2 y T2 son el volumen, la presión y la temperatura final.
La Ley General de los Gases propone que, combinando las leyes anteriores, se tiene que: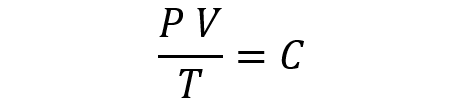
Aquí, P es la presión, V es el volumen, T es la temperatura y C es una constante.
Gases ideales
Se llama gases ideales a los gases hipotéticos o teóricos que son un modelo de gases creado por el ser humano para estudiar y explicar el comportamiento de los gases de una forma más sencilla. Para estudiar este tipo de gases se puede usar la ecuación de estado de los gases ideales que se representa como:
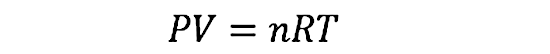
Donde P es la presión, V es el volumen, T es la temperatura, n el número de moles de gas (que debe permanecer constante) y R la constante de los gases ideales (igual a 8.314472 J/molK).
Las propiedades de los gases ideales son:
- Están formados por un número determinado de moléculas.
- No hay fuerzas de atracción o de repulsión entre sus moléculas.
- No hay colapso alguno entre las moléculas, ni cambios en su naturaleza física (es decir, cambios de fase).
- Un gas ideal ocupa siempre el mismo volumen, en las mismas condiciones de presión y temperatura.
Gases reales
Los gases reales son los que existen en la vida real. El comportamiento de estos gases no se puede estudiar utilizando la ecuación de estado de los gases ideales, sino que su estudio requiere el empleo de ecuaciones más complejas. En los gases reales, a diferencia de los ideales, hay que tener en cuenta las interacciones entre sus partículas. Además, en estos gases pueden existir transiciones de fase.
Cambios de estado en los gases

- Evaporación. También llamado “vaporización” es el proceso en el que un líquido pasa al estado gaseoso. Este proceso ocurre cotidianamente, cuando aumenta la energía calórica de los líquidos, por ejemplo, por acción de la luz solar o cuando se calientan. La evaporación ocurre de manera gradual y no es necesario que todo el líquido se caliente hasta su punto de ebullición (temperatura a la que la presión de vapor del líquido se iguala a la presión que rodea al líquido), es suficiente con que se caliente para que se vaya evaporando de a poco.
- Ebullición. Es el proceso mediante el cual, al aumentar la temperatura de un líquido por encima de su punto de ebullición, se transforma en gas. Para que ocurra es necesario que toda la masa del líquido se caliente a una temperatura igual o superior al punto de ebullición.
- Sublimación. Es el proceso de cambio de fase que lleva del estado sólido al estado gaseoso, sin pasar antes por el líquido. Aunque en determinadas condiciones de presión y temperatura puede ocurrir con el hielo, ocurre más frecuentemente con otras sustancias, como el yodo, que a 184 ºC pasa directamente de estado sólido a gaseoso.
- Sublimación inversa. También llamado deposición, este cambio de fase es contrario a la sublimación, es decir, involucra el paso de gaseoso directamente a sólido, sin pasar antes por el estado líquido. Tiene lugar bajo condiciones muy puntuales de presión, que fuerzan las partículas del gas a juntarse hasta formar estructuras moleculares rígidas. Un ejemplo habitual de sublimación inversa se da en los polos de la Tierra, en las cumbres de las montañas o en cualquier otro ambiente donde la temperatura es tan baja, que no se forma agua líquida a partir de la humedad, sino hielo y nieve.
- Condensación. Es el proceso contrario a la evaporación, involucra la sustracción de energía calórica de un gas. Como consecuencia, sus partículas se mueven más lentamente y se juntan con mayor facilidad, y se convierten en gotas de líquido sobre las superficies o se precipitan al suelo. Esto es lo que ocurre en la baja atmósfera cuando, tras alejarse de la superficie de la Tierra, el vapor de agua evaporado se enfría y forma nubes, de las que caen de vuelta las gotas de agua hacia el suelo: eso es la lluvia. También puede ocurrir cuando la humedad ambiental (estado gaseoso) entra en contacto con una superficie fría, como una botella.
Ejemplos de compuestos en estado gaseoso

Algunos ejemplos de materia en estado gaseoso son:
- Vapor de agua. Al evaporarse, el agua cambia al estado gaseoso en forma de vapor: algo perfectamente evidente cuando hervimos agua y surge una columna de vapor blanquecino de la olla.
- Aire. El aire que respiramos es una masa homogénea de gas, mezcla de elementos muy distintos como oxígeno (O2), hidrógeno (H2) y nitrógeno (N2), que son generalmente transparentes, incoloros e inodoros.
- Butano. Es un gas de naturaleza orgánica y derivado del petróleo, compuesto por hidrocarburos inflamables. Es comúnmente empleado como combustible para generar fuego en nuestras cocinas, cuando abrimos la llave y este gas emerge.
- Metano. Es otro gas hidrocarbúrico, subproducto frecuente de los procesos de descomposición de la materia orgánica. Es posible hallarlo en ciénagas, cloacas o incluso en los intestinos de los animales, donde hay bacterias anaeróbicas que lo producen. Posee un olor desagradable muy característico.






¿Te fue útil esta información?
Sí No¡Genial! Muchas gracias por visitarnos :)