Te explicamos qué son los elementos químicos, cómo se originaron y su clasificación. Además, cuáles son sus características y algunos ejemplos.

¿Qué son los elementos químicos?
Se denomina elemento químico a la materia que está compuesta de un mismo tipo de átomo, es decir, que es atómicamente pura. Son sustancias que no pueden ser descompuestas en otras más simples mediante reacciones químicas y que se encuentran clasificadas en la tabla periódica de los elementos químicos.
No debe confundirse a los elementos con las sustancias simples, ya que en ciertos casos dos o más átomos de un mismo tipo pueden agruparse de manera distinta. Por ejemplo, a partir de átomos de oxígeno (O) pueden componerse dos sustancias simples: ozono (O3) y oxígeno molecular (O2).
La mayoría de los elementos conocidos provienen de la naturaleza, donde pueden hallarse de manera monoatómica o formando compuestos con otros elementos. Algunos incluso existen en forma artificial, debido a la inventiva del hombre.
Dependiendo del elemento que sea, tendrá ciertas propiedades y, por ende, distintos usos y aplicaciones.
Tampoco debe confundirse a los elementos químicos con los “cuatro elementos” (agua, fuego, aire, tierra), que responden a una clasificación antigua de las fuerzas involucradas en la naturaleza.
Ver además: Separación de mezclas
Origen de los elementos químicos
Los elementos químicos se forman, hasta donde sabemos, en el interior de las estrellas, como producto de complejos procesos de fusión y fisión atómica que generan cada vez elementos más pesados en un proceso llamado nucleosíntesis.
Asumimos que así se habría originado toda la materia del universo, excepto aquella que los seres humanos hemos podido crear por cuenta propia en nuestros laboratorios y reactores nucleares.
Nomenclatura y representación de los elementos químicos

Los elementos químicos suelen ser bautizados con nombres provenientes de la tradición mitológica grecorromana, como es el caso del mercurio, ya que muchas de las teorías sobre el origen y la esencia del universo que durante siglos manejamos provienen de dichas culturas.
En otros casos, no obstante, se suele dar un nombre derivado del apellido de su descubridor, como ocurre con el lawrencio, llamado así en honor al equipo de físicos del Lawrence Berkeley National Laboratory que lo sintetizó por primera vez.
Los elementos químicos son representados mediante una o la combinación de letras (siglas), que resume el nombre entero del átomo, por ejemplo: oxígeno (O), mercurio (Hg) y lawrencio (Lr).
Abundancia de los elementos químicos
Existen en la actualidad 118 elementos químicos conocidos, entre los naturales y los artificiales. Los primeros tienden a hallarse en estado puro (como el helio atmosférico) o formando compuestos químicos (como el hierro, rara vez en estado puro). Ello dependerá de la reactividad del elemento y de sus afinidades características.
Los elementos artificiales, por lo general, son más bien inestables y a menudo liberan cantidades de energía y materia (radiactividad) que son peligrosas para la salud. Este proceso de descomposición puede durar fracciones de segundo, como en el caso del oganesón (Og), o puede demorar cientos y hasta millones de años, como ocurre con el plutonio (Pu).
Tabla periódica
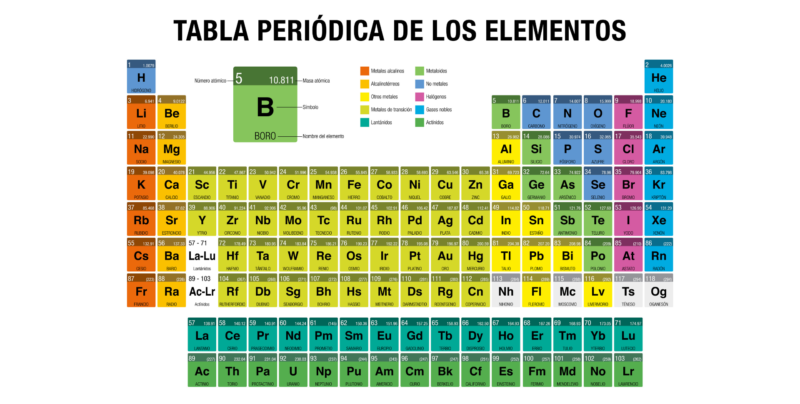
La tabla periódica de los elementos fue creada por Dmitri Mendeléyev en 1869, para ordenar visualmente los elementos químicos conocidos en base a sus propiedades y características.
En la actualidad, luego de numerosas actualizaciones y modificaciones, usamos una versión nueva en la que figuran los elementos recientemente sintetizados y que sirve de herramienta para el estudio atómico de la naturaleza.
Clasificación de los elementos químicos
Los elementos químicos pueden clasificarse en base a sus propiedades, tal como las distingue y organiza la tabla periódica. En ese sentido, hablamos de:
- Metales. Son elementos sólidos a temperatura ambiente (excepto el mercurio), densos y muy buenos conductores de calor y electricidad. Generalmente son brillantes, es decir, reflejan la luz. Se clasifican a su vez en actínidos, lantánidos, metales de transición, alcalinos, alcalino-térreos y otros metales.
- No metales. Son elementos que no son buenos conductores de calor ni de electricidad y son demasiado débiles para poder laminarse o estirarse como ocurre con los metales. En su mayoría, son esenciales para los sistemas biológicos (compuestos orgánicos).
- Metaloides. Son elementos que corresponden a una clasificación intermedia entre metales y no metales, y que reúnen características de ambos grupos. Se los conoce como semimetales.
- Halógenos. Es un grupo de seis elementos que tienden a formar moléculas diatómicas muy activas químicamente, debido a su electronegatividad: suelen formar iones (moléculas cargadas eléctricamente) mononegativos. Los halógenos son altamente oxidantes, por lo que estos elementos suelen ser cáusticos y corrosivos.
- Gases nobles. Es un grupo de siete elementos cuyo estado natural es el gaseoso. Existen, por lo general, en su forma monoatómica de muy baja reactividad y por eso se los conoce también como gases inertes. Comparten la mayoría de sus propiedades físicas y son sumamente estables.
Numero atómico

El número atómico es un número representado por la letra Z que indica el número de protones que se encuentran en el núcleo de los átomos de un elemento. En la Tabla Periódica se suele presentar en la parte superior izquierda del recuadro de cada elemento.
Esta información es muy importante en la química y la física cuántica: recordemos que los protones tienen carga positiva y los electrones carga negativa, por lo que el número atómico sirve para entender (junto con el número de electrones) el comportamiento electromagnético de los átomos.
Masa atómica
La masa de un átomo es el equivalente a la suma del número de partículas que tiene su núcleo: protones y neutrones.
Dado que un elemento químico tiene varios isótopos (átomos de un mismo elemento químico que tienen distinta cantidad de neutrones) con diversa masa atómica, se suele calcular la masa atómica de un elemento como el promedio de la de todos sus isótopos conocidos.
Sin embargo, hoy se sabe que este procedimiento no es del todo correcto porque si el elemento tiene uno de sus isótopos en gran mayoría, la masa calculada como un promedio estaría referida principalmente a la masa del isótopo mayoritario. La manera estricta de calcular la masa de un átomo es calcular la masa del isótopo de interés y no promediando la masa de todos los isótopos.
Valencia

La valencia es el número de electrones que un átomo de un elemento puede ceder o aceptar para completar su órbita más externa (último nivel de energía).
En base a ello, el átomo podrá formar enlaces covalentes, iónicos o metálicos, compartiendo o transfiriendo estos electrones con otro átomo. Algunos átomos poseen más de una valencia, por lo que este concepto a menudo se prefiere llamar “número de oxidación”.
Isótopos

Los átomos de un mismo elemento pueden variar entre sí, de acuerdo a sus propiedades nucleares y energéticas. Se llaman isótopos a los átomos de un mismo elemento químico que se comportan distinto en lo que se refiere a su núcleo. Los isótopos son distintos átomos de un mismo elemento químico pero que tienen la misma cantidad de protones y diferente cantidad de neutrones en su núcleo.
Por ejemplo, el plutonio es un elemento radiactivo, cuyo isótopo plutonio-238 termina por convertirse en plomo-206; pero su isótopo de mayor duración es el plutonio-244, con una vida media (tiempo que tarda un núcleo en desintegrarse) de 80 millones de años. En cambio, el plutonio-239 dura unos 24.100 años, y el plutonio-238 dura apenas 88 años.
Ejemplos de elementos químicos
Los elementos químicos más conocidos son:
- Oxígeno (O)
- Carbono (C)
- Hidrógeno (H)
- Nitrógeno (N)
- Azufre (S)
- Hierro (Fe)
- Cobre (Cu)
- Oro (Au)
- Plata (Ag)
- Mercurio (Hg)
- Zinc (Zn)
- Helio (He)
- Fósforo (P)
- Silicio (Si)
- Sodio (Na)
- Litio (Li)
- Calcio (Ca)
- Platino (Pt)
- Níquel (Ni)
- Cloro (Cl)
- Argón (Ar)
- Uranio (U)
- Flúor (F)
- Potasio (K)
- Neón (Ne)
- Arsénico (As)
- Cromo (Cr)
Puede servirte: Átomo de Carbono
Referencias
- "The periodic table of elements" en WebElements.
- Ley periódica y sistema periódico de los elementos de Mendeleiev. N. P. Agafoshin. 1977. ISBN: 978-84-291-7021-4
- Nature's building blocks : an A-Z guide to the elements. Emsley, John. 2003. ISBN: 0198503407
- "Elemento químico" en Wikipedia.





¿Te fue útil esta información?
Sí No¡Genial! Muchas gracias por visitarnos :)