Te explicamos qué es un enlace covalente, su polaridad y cómo se clasifica. Además, cuáles son sus características y algunos ejemplos.
¿Qué es un enlace covalente?
Un enlace covalente es un tipo de enlace químico en el que dos átomos se unen compartiendo electrones en su capa atómica más superficial o de su último orbital atómico (probabilidad de encontrar un electrón alrededor del núcleo), y alcanzando así el octeto estable (según la “regla del octeto” de Gilbert Newton Lewis). Los átomos enlazados comparten uno (o más) pares de electrones.
Este tipo de enlace se diferencia del enlace iónico en que los átomos que lo forman tienen una diferencia de electronegatividad menor que 1,7, mientras que en el enlace iónico tienen una diferencia mayor que 1,7.
Los enlaces covalentes se forman entre átomos de iguales o distintos elementos no metálicos y entre un no metal y el hidrógeno.
Los enlaces covalentes son distintos de los enlaces iónicos, pues en la formación de los enlaces iónicos hay una transferencia de electrones de un átomo a otro, formando iones de cargas opuestas que luego se atraen electrostáticamente. Además, el enlace iónico se forma entre átomos de un metal y un no metal.
Ver además: Moléculas
Regla del octeto
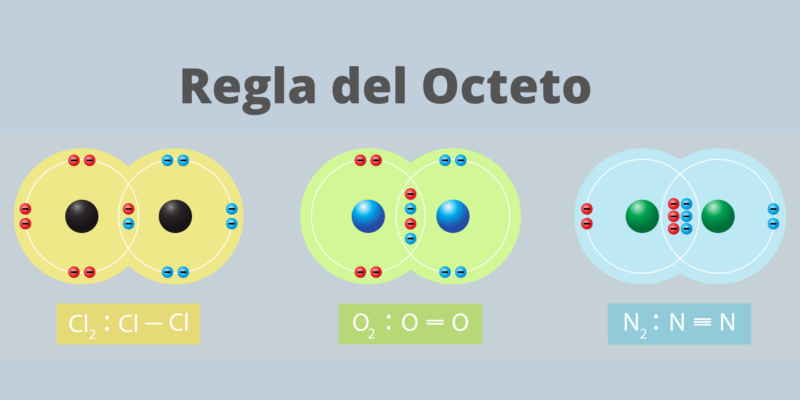
La “regla del octeto” fue formulada por Gilbert Lewis a principios del siglo XX, para describir la tendencia de los átomos a juntarse para lograr una capa electrónica exterior “completa” o “cerrada”, de acuerdo a su valencia (número de electrones que debe aceptar o ceder un átomo para completar su última capa). Este principio es el que rige los enlaces covalentes.
Dicha capa completa consistiría en ocho (8) electrones, por lo que un átomo con valencia 6 buscaría un par más y un átomo con valencia 2 buscaría tener hasta seis más, pues en esta configuración el átomo goza de mucha estabilidad, semejante a la que presentan los gases nobles.
Diferencias con el enlace iónico (electrovalente)
Mientras que el enlace covalente, como se ha dicho, consiste en compartir pares de electrones de la capa exterior de los átomos juntados, los enlaces iónicos consisten en transmitir o prestar un electrón entre un átomo y el otro.
Para que esto se produzca, uno de los dos átomos debe ceder uno o más electrones al otro átomo. Entonces, los átomos deben ser de un elemento metálico y uno no metálico. Así, se forman iones con carga positiva (cationes, provenientes del metal) y iones con carga negativa (aniones, provenientes del no metal) que se atraen electrostáticamente para formar el enlace.
Dipolo eléctrico
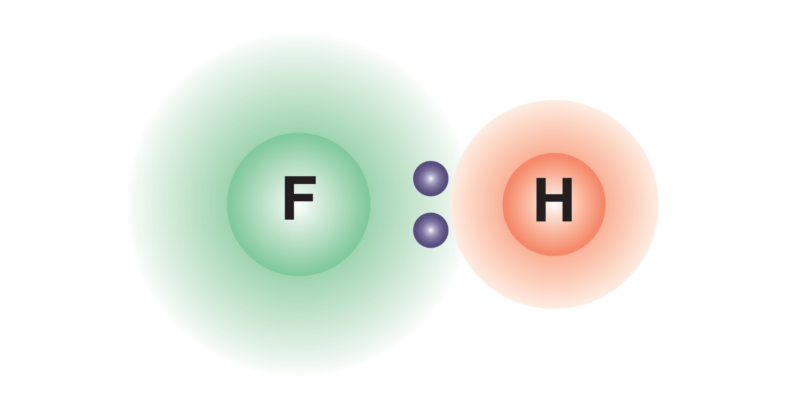
Los enlaces covalentes entre átomos de elementos químicos diferentes suelen producir una distribución desigual de la densidad de carga eléctrica sobre el compuesto químico formado, lo que genera un dipolo eléctrico (sistema de dos cargas de signo opuesto e igual magnitud). Esto ocurre debido a que uno de los átomos es más electronegativo que el otro, por lo que atraerá hacia sí mismo con mayor fuerza a los electrones del enlace, generando una densidad de carga negativa sobre él y una positiva sobre el otro átomo, lo que lleva a la formación del dipolo.
Esto permite que las moléculas covalentes se junten con otras similares y se construyan estructuras moleculares más complejas.
En el caso de que el enlace se forme con átomos del mismo elemento, la distribución de cargas sobre el compuesto químico formado será igual sobre toda su estructura, por lo que no se debe producir un dipolo eléctrico.
Polaridad
La polaridad es una propiedad de los compuestos químicos que tienen una distribución no uniforme (desigual) de cargas sobre su estructura, por lo que está estrechamente relacionada con la formación de dipolos eléctricos. Conforme a la presencia o no de polaridad, es posible distinguir entre enlaces covalentes polares (que forman moléculas polares) y enlaces covalentes no polares (que forman moléculas no polares o apolares).
- Enlaces covalentes polares. Se producen entre átomos de diferentes elementos químicos y que tienen una diferencia de electronegatividad mayor a 0,5. Estos enlaces forman el dipolo electromagnético.
- Enlaces covalentes no polares o apolares. Se forman entre átomos del mismo elemento químico, cuya electronegatividad es la misma. También se forman entre átomos de distintos elementos químicos, pero que tienen una diferencia de electronegatividad muy pequeña (menor a 0,4). Dado que la nube electrónica es atraída de igual forma por ambos núcleos, no se forma el dipolo en la molécula.
Tipos de enlace covalente
Existen los siguientes tipos de enlace covalente:
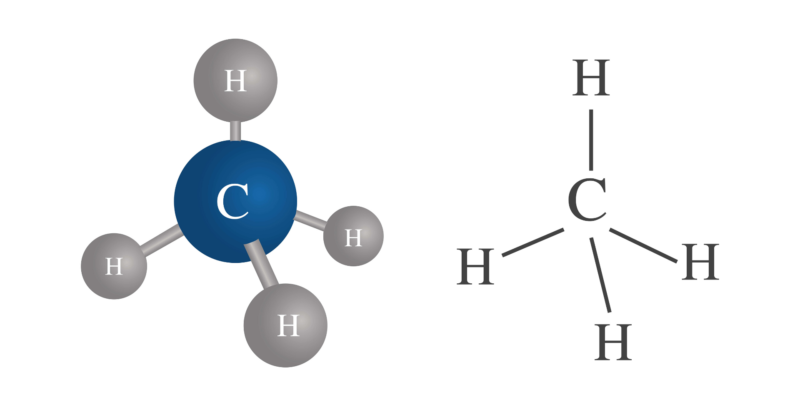
- Simple. Los átomos comparten un par de electrones de su última capa (un electrón de cada uno). Por ejemplo: H-H, H-Cl.
- Doble. Los átomos aportan dos electrones cada uno, formando un enlace doble de cuatro electrones. Por ejemplo: O=O, O=C=O.
- Triple. Los átomos aportan tres electrones para formar tres pares electrónicos, es decir, seis electrones en total formando el triple enlace. Por ejemplo: N≡N.
- Dativo. Un enlace covalente en que uno de los dos átomos aporta dos electrones y el otro ninguno. Por ejemplo: NH4+.
Ruptura de enlaces covalentes
Cuando los átomos se enlazan covalentemente, suelen desprender energía. Por ende, para romper dicho enlace es necesario suministrar esa energía perdida, que variará de acuerdo al tipo de átomos enlazados y al tipo de enlace covalente formado. Así, la energía de enlace es la energía total que se desprende cuando se forma un mol de enlaces covalentes y es la misma que habría que aplicar para romper ese mol de enlaces.
Por ejemplo, para romper los enlaces covalentes de 1 mol de moléculas de hidrógeno (H2), es necesario aplicar 104 kilocalorías/Kcal (435 kilojulios/kJ).
Tipos de sustancias covalentes
Las sustancias cuyos átomos presentan enlaces covalentes pueden ser de dos tipos:
- Moleculares. Forman moléculas con temperaturas de fusión y ebullición bajas, aislantes térmica y eléctricamente, blandos cuando son sólidos y solubles en otras sustancias de similar polaridad (polares en polares y no polares en no polares). Por ejemplo: el oxígeno (O2).
- Reticulares. Forman redes cristalinas de átomos (parecidas a los compuestos iónicos) y que presentan elevadas temperaturas de fusión y ebullición, dureza y solidez en condiciones normales de presión y temperatura (1atm y 25 °C), insolubilidad y son aislantes térmicos y eléctricos. Por ejemplo: el cuarzo.
Valencia atómica
La valencia es la cantidad de electrones que un átomo debe ceder o aceptar para completar su capa más externa. Es un dato imprescindible a la hora de estudiar los enlaces covalentes, pues nos dice cuántos electrones requiere el átomo para alcanzar la estabilidad.
Esta valencia puede variar en un mismo átomo. Por ejemplo, el carbono (C) tiene valencia 4, el hidrógeno (H) valencia 1, pero el azufre (S) puede tener valencia 2, 4 y 6.
Ejemplos de sustancias polares y no polares
De acuerdo a la polaridad de los enlaces covalentes que presentan sus moléculas, puede hablarse de compuestos polares como:
- Metanol, fenol, acetona, ácido propiónico.
Y sustancias no polares como:
- Etano, tolueno, isobutano, n-Pentano.
Ejemplos de compuestos con enlace covalente
- Una molécula de oxígeno (O2): O=O (enlace doble)
- Una molécula de hidrógeno (H2): H-H (enlace simple)
- Una molécula de dióxido de carbono (CO2): O=C=O (enlaces dobles)
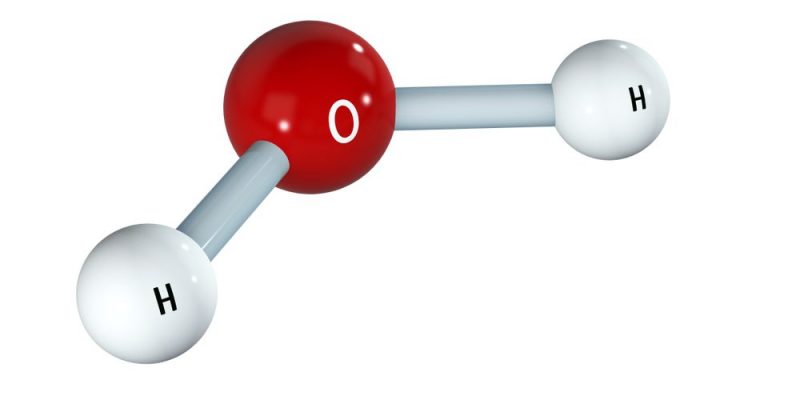
- Una molécula de agua (H2O): H-O-H (enlaces simples)
- Una molécula de ácido clorhídrico (HCl): H-Cl (enlaces simples)
- Una molécula de nitrógeno (N2): N≡N (enlace triple)
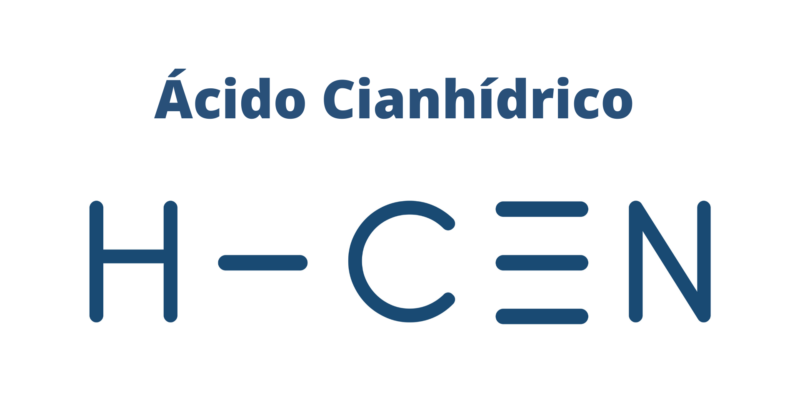
- Una molécula de ácido cianhídrico (HCN): H-C≡N (enlace simple y enlace triple)
Puede servirte: Química orgánica
Referencias
- Introducción al enlace químico. Dr. Laura Gasque Silvia. (PDF)
- Química. 1era edición en español. Franchini William y Seese G. William Daub. México: Prentice-Hall Hispanoamericana. 1989. ISBN: 968-880-167-4.
- Química II. Antonio Cuevas Quintero, Beatriz Brambila Horta, Alicia Galindo Trejo y Cecilia P. Flores Jiménez. Editorial Umbral. 2004. ISBN: 968-5607-20-6.
- "Enlace Covalente" en Wikipedia.





¿Te fue útil esta información?
Sí No¡Genial! Muchas gracias por visitarnos :)