Te explicamos qué es el ácido clorhídrico, cómo es su fórmula y las propiedades que posee. Además, sus características y efectos nocivos.

¿Qué es el ácido clorhídrico?
Se llama ácido clorhídrico, ácido muriático, espíritu de sal, ácido marino, aguafuerte, salfumán e incluso ácido hidroclórico a un compuesto químico binario cuyas moléculas se constituyen de un átomo de cloro y otro de hidrógeno, por lo que su fórmula química es HCl.
Se trata de una disolución acuosa del gas cloruro de hidrógeno (de idéntica composición química), sumamente irritante y corrosiva.
Este compuesto, el cloruro de hidrógeno, puede producirse artificialmente o puede también generarse naturalmente, como consecuencia de la erupción volcánica, la quema de hidrocarburos o incluso por ciertos seres vivos.
Para obtener ácido clorhídrico basta con hacer que el cloruro de hidrógeno entre en contacto con el agua.
Ver además: Ácido acético
Importancia del ácido clorhídrico
El ácido clorhídrico cumple roles importantes en la industria química humana, ya que permite la producción de sustancias más complejas.
También permite la eliminación de residuos en un recipiente donde ha ocurrido una reacción química, lo que facilita la generación de otra reacción en ese mismo recipiente sin que intervenga algún componente generado en la reacción anterior.
Por otro lado, el hecho de que nuestros propios cuerpos lo segreguen significa que es una sustancia útil en cantidades controladas, pero que de ningún modo debe ser ingerido o aspirado.
Propiedades del ácido clorhídrico

Propiedades químicas
- Reacciona con muchos metales para formar hidrógeno. También reacciona con el agua liberando calor. Puede reaccionar con agentes oxidantes fuertes.
- Se utiliza como reactivo para generar muchas reacciones químicas. Es bastante corrosivo.
- Puede disolver metales (formando iones metálicos oxidados), tejidos orgánicos o incluso sales y minerales.
Propiedades físicas
- Su pH es inferior a 1, es decir, es sumamente ácido.
- Su apariencia es de un líquido transparente o amarillento, dependiendo de la concentración de cloruro de hidrógeno, que es un gas ligeramente amarillo, no inflamable y más pesado que el aire.
- Aunque es muy peligroso, si se lo compara a otros ácidos fuertes comunes en química, se trata de uno relativamente menos peligroso de manipular.
- Sus propiedades físicas (como el pH específico, la densidad y sus puntos de fusión y ebullición) varían de acuerdo a su concentración en agua. Por ejemplo, el punto de ebullición para una disolución acuosa con un 10 % de ácido clorhídrico es 103 °C, mientras que para una con un 38 % es 48 °C.
Ácido clorhídrico en el cuerpo humano
El ácido clorhídrico es un irritante muy potente, capaz de dañar cualquier tejido orgánico con el que entre en contacto. La exposición a esta sustancia como gas (cloruro de hidrógeno) puede irritar las vías respiratorias y, dependiendo de su concentración, la interrupción del ciclo respiratorio y la muerte por asfixia.
En su solución acuosa (ácido clorhídrico), es capaz de producir irritación de la piel o corroerla absolutamente produciendo quemaduras químicas y posibles desfiguraciones o la muerte. Además, su mezcla con lejía y otros agentes oxidantes produce el gas dicloro, altamente tóxico.
Por otro lado, los llamados jugos gástricos, cuya tarea es descomponer la comida ya masticada y permitir su absorción a través de los intestinos, se da gracias a la presencia de aproximadamente un 3 % de ácido clorhídrico en nuestro estómago.
Este ácido permite la desnaturalización de proteínas y no genera daños en un estómago sano, gracias a la resistencia de las capas internas de este órgano, y al bicarbonato de sodio segregado por algunas células (y otros órganos como el páncreas) para regular el nivel de acidez.
En algunos casos, sin embargo, este proceso puede salirse de control y producir acidez, úlceras o cuadros patológicos peores.
Usos del ácido clorhídrico

El ácido clorhídrico es un ácido barato, fuerte y volátil, con muchas aplicaciones. Se lo utiliza, por ejemplo:
- En la fabricación de limpiadores, solventes y otros químicos de limpieza.
- Para eliminar incrustación de caliza (carbonato de calcio) de otros minerales.
- Para regular la acidez de otras soluciones químicas.
- Para disolver la parte mineral de los huesos, en la fabricación de la gelatina.
- Para disolver las capas de óxido de los metales en la industria metalúrgica.
- En la síntesis de otros materiales químicos como tricloruro de hierro (FeCl3) o la síntesis de cloruros orgánicos.
¿Cómo fue descubierto el ácido clorhídrico?

Se le suele atribuir su descubrimiento a Jabir ibn Hayyan (Geber), de manera errónea. Este compuesto era conocido en la Edad Media por los alquimistas, que lo llamaban espíritu de la sal o acidum salis.
Los primeros experimentos para obtener cloruro de hidrógeno tuvieron lugar en el siglo XVII en Alemania, por parte de Johann Rudolf Glauber, y en 1772 en Inglaterra por Joseph Priestley, quien lo obtuvo en un porcentaje de pureza importante.
Su composición de hidrógeno y cloro fue demostrada ese mismo año por el también inglés Humphry Davy.
¿Cómo se obtiene el ácido clorhídrico?
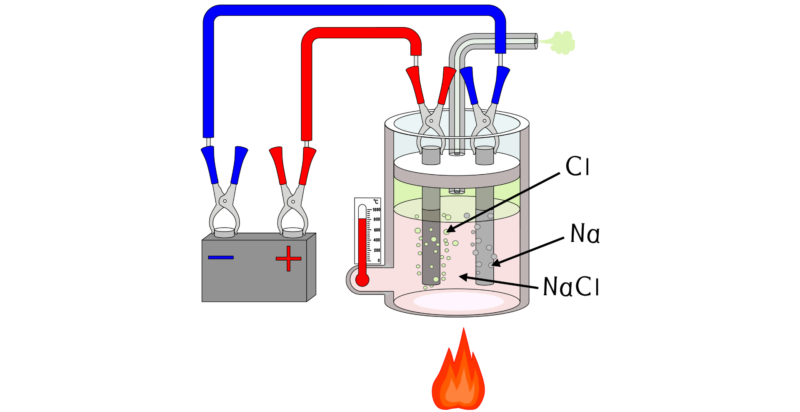
En laboratorios, el ácido clorhídrico se obtiene de la adición de ácido sulfúrico (H2SO4) a sal común (NaCl), calentando la mezcla a 150 °C.
A gran escala, se utiliza otro método que consiste generalmente en la electrólisis de una solución de sal común para producir dicloro (Cl2), hidróxido de sodio (NaCl) y dihidrógeno (H2). Luego se combina el dicloro con el dihidrógeno, ambos gases, formando HCl. Esta es una reacción exotérmica.
¿Qué es una quemadura química?
Una quemadura química es una reacción dañina y dolorosa que se produce al exponer un tejido vivo a una sustancia corrosiva (muy ácida o muy alcalina).
Se trata de una sustancia que deteriora la materia orgánica y causa la desnaturalización de las sustancias que la componen y la disuelve en sustancias más simples.
Estas quemaduras pueden presentar diversos síntomas dependiendo del compuesto que las ocasione pero, por lo general, son inmediatas y extremadamente dolorosas. Además, ocurren sin fuente externa de calor (aunque en muchos casos se deben a una reacción química exotérmica) y pueden producir deformidades, pérdida de tejido corporal o la muerte.
Sigue con: Ácido Sulfúrico
Referencias
- “Ácido clorhídrico” en Wikipedia.
- “Ácido clorhídrico. Propiedades y aplicaciones de esta solución” en Ácidos.info.
- “Tratamiento de ácido clorhídrico” en De Dietrich Process Systems.
- “Hydrochloric acid (chemical compound)” en The Enciclopaedia Britannica.
- “Ácido clorhídrico” en Pocheca.
- “Acido clorhídrico” en Chemical Safety Facts.





¿Te fue útil esta información?
Sí No¡Genial! Muchas gracias por visitarnos :)