Te explicamos qué son los alcanos, los usos y propiedades que presentan estos hidrocarburos y sus características generales.

¿Qué son los alcanos?
Los alcanos conforman una de las principales familias de hidrocarburos (compuestos orgánicos formados por átomos de carbono e hidrógeno).
Los alcanos son muy importantes como combustibles hogareños e industriales ya que se utilizan para el funcionamiento de calderas, turbogeneradores y cocinas a gas, entre otros. También son insumos en diversas industrias como la del vidrio, la textil y la de plástico.
Ver además: Química orgánica
Tipos de alcanos
Los alcanos pueden ser alifáticos o cicloalcanos.
- Alcanos alifáticos. También llamados parafinas, tienen una estructura lineal y obedecen a la fórmula general CnH2n+2, donde n representa el número o cantidad de átomos de carbono en el compuesto (contienen más del doble de átomos de hidrógeno que de carbono)
- Cicloalcanos. Tienen una estructura en forma de ciclo y su fórmula general es CnH2n.
Características de los alcanos

- Están asociados a los seres vivos. Aunque los alcanos no son materiales esenciales para los seres vivos, a menudo aparecen como productos intermedios o finales del metabolismo microbiano. Tal es el caso, por ejemplo, de la fermentación metanogénica que realizan las bacterias del rumen de los animales
- Algunos alcanos, como el metano (CH4), pueden ser inflamables, explosivos o tóxicos, de modo que se deben manejar con extrema precaución.
- Son hidrocarburos saturados porque los enlaces entre los átomos de carbono son simples y estables. Esto los diferencia de los alquenos y los alquinos, que se caracterizan por tener enlaces dobles y triples, respectivamente, entre sus átomos de carbono. Por ejemplo:
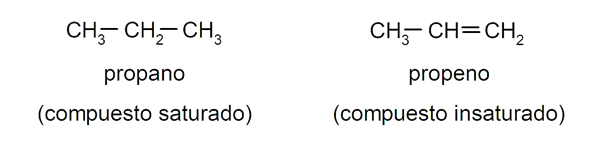
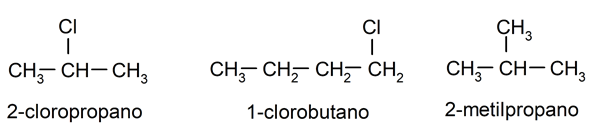
- Pueden presentar sustituyentes. Los átomos de hidrógeno enlazados a cada átomo de carbono pueden sustituirse por otros átomos, como halógenos (flúor, bromo, cloro) o diversos grupos o “radicales” (son muy frecuentes los grupos hidroxilo (OH-) y metilo (CH3-)). En este último caso, la estructura se va complejizando dando lugar a alcanos ramificados. Por ejemplo:
- Pueden formar estructuras cerradas. Los átomos de carbono se van enlazando entre sí dando lugar a la formación de cadenas, pero los extremos de dichas cadenas pueden combinarse y formar entonces los denominados alcanos cíclicos, como en el caso del ciclohexano, el ciclopentano y el ciclobutano.

Propiedades físicas de los alcanos

Las propiedades físicas de los alcanos están en gran medida determinadas por el número de átomos de carbono que contienen en su estructura. Así por ejemplo, los alcanos que tienen entre 1 y 4 átomos de carbono son gases a temperatura ambiente; aquellos que tienen entre 5 y 17 átomos de carbono son líquidos a esa misma temperatura y los que tienen 18 carbonos o más son sólidos a temperatura ambiente.
- Escasa solubilidad. En general, los alcanos son poco o nada solubles en agua y, a medida que aumenta el peso molecular, la solubilidad se torna incluso menor. En solventes orgánicos, sin embargo, la solubilidad es alta.
- Baja densidad. Su densidad es menor que la del agua, por eso tienden a flotar. Esto se ve muy bien cuando se producen derrames de hidrocarburos en el mar, como por ejemplo, los derrames de petróleo (mezcla de muchos hidrocarburos). Por otro lado, la densidad de los alcanos aumenta a medida que aumenta su masa molecular, es decir, la cantidad de átomos de carbono.
- Punto de fusión y ebullición variable. El punto de fusión y de ebullición dependen del número de átomos de carbono (a mayor número, más elevado es el punto de fusión y el de ebullición), pero también de la estructura: las estructuras lineales tienen un punto de fusión y ebullición más alto que las ramificadas. El punto de ebullición de los alcanos aumenta aproximadamente 30 °C cada vez que se agrega un átomo de carbono al compuesto.
- Conductividad eléctrica. Por lo general, los alcanos no conducen la electricidad.
Reacciones químicas de los alcanos
Las reacciones más comunes que pueden sufrir los alcanos son:
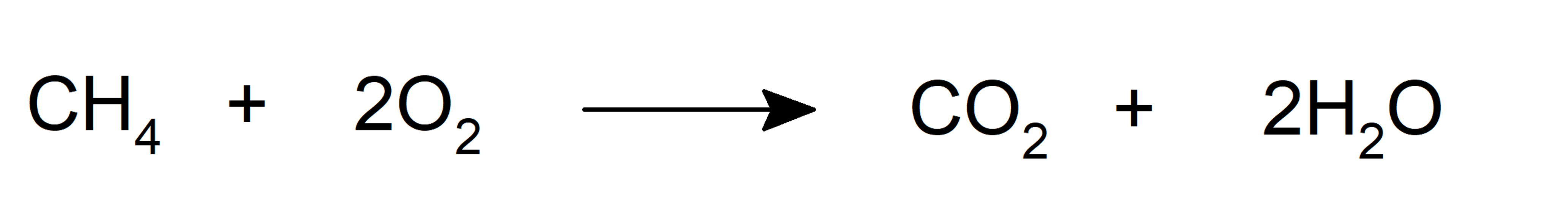
- Oxidación. Al combinarse con el oxígeno pueden formar dióxido de carbono y agua y liberar energía bajo la forma de calor. Esta es la típica reacción de combustión.
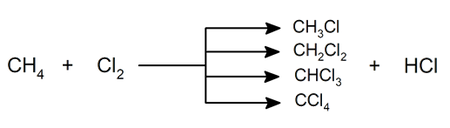
- Halogenación. Tanto el cloro como el bromo, el flúor y el yodo pueden sustituir a átomos de hidrógeno del alcano. Los productos de reacción consisten en distintas proporciones de diferentes alcanos halogenados. Un ejemplo es el cloroformo, que es un hidrocarburo halogenado (el triclorometano).
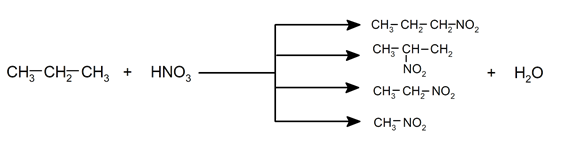
- Nitración. A altas temperaturas y en presencia de vapores de ácido nítrico, se puede producir la sustitución de un hidrógeno por el grupo NO2-, lo que genera nitroalcanos en distintas proporciones.
- Isomerización. Es la reestructuración de la molécula sin pérdida ni ganancia de átomos. Por lo general, esta reacción requiere el uso de catalizadores. Por ejemplo:
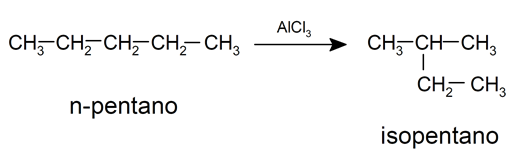
- Pirólisis. Es la descomposición de los alcanos por exposición a muy elevada temperatura y sin presencia de aire, de esta forma se evita su combustión y se prioriza la descomposición de las moléculas rompiendo sus enlaces químicos. Esta reacción se utiliza en la industria para obtener alquenos y alcanos de cadenas cortas a partir de alcanos de cadenas más largas.
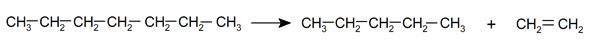
Sigue con: Ácido clorhídrico
Referencias
- Introducción a la Química Orgánica. Juan Carlos Autino. Gustavo Romanelli, Diego Manuel Ruíz.
- Principios de Bioquímica. Quinta edición. Lehninger.
- "Alcano" https://es.wikipedia.org/





¿Te fue útil esta información?
Sí No¡Genial! Muchas gracias por visitarnos :)