Índice
Te explicamos qué son las moléculas, cómo se clasifican y sus propiedades. Además, cuáles son sus características y ejemplos.

¿Qué son las moléculas?
Se denomina molécula a un conjunto eléctricamente neutro, estructurado e interrelacionado de átomos que pertenecen a un mismo elemento químico o a varios. Por ejemplo, la molécula de dihidrógeno (H2) está formada solo por átomos de hidrógeno, mientras que la molécula de metano (CH4) está formada por un átomo de carbono y cuatro de hidrógeno.
Estos conjuntos se forman gracias a fuerzas de atracción interatómicas llamadas enlaces químicos, debido a las que se forman estructuras compuestas por átomos que son más estables que los átomos por separado.
Otra forma que se ha usado para definir una molécula pero que a veces no es aceptada por algunos científicos consiste en que es la parte más pequeña, que aún conserva sus propiedades físicas y químicas, en que puede dividirse una sustancia química. Según esta definición, existen moléculas compuestas por un solo átomo, como por ejemplo, el helio (He).
Las propiedades de una sustancia específica están determinadas por las propiedades de las moléculas que la conforman. Por lo tanto, de la estructura de las moléculas de una sustancia y de la fuerza de las interacciones entre ellas, dependerá si se trata de un sólido (poca separación entre las moléculas), un líquido (separación mediana) o un gas (mucha separación).
Existen otros compuestos químicos que también están formados por conjuntos de átomos eléctricamente neutros, pero que no son moléculas. Entre ellos se encuentran los minerales que conforman la Tierra, los cristales iónicos (sales) o covalentes y otros materiales semejantes (como el vidrio o los metales). Es decir que no puede hablarse como tal de una molécula de vidrio, ni de hierro, ni de aluminio.
¿Cómo fueron descubiertas las moléculas?
La idea de que la materia está compuesta de partículas indivisibles unidas entre sí es tan vieja como la Antigua Grecia, cuando el filósofo Demócrito la propuso.
Sin embargo, la hipótesis atómica en términos científicos se propuso apenas en 1803, cuando el químico inglés John Dalton comprobó que la materia se formaría a partir de uniones estables de átomos llamadas moléculas.
La naturaleza de los átomos y de dichas moléculas fue explorada con mayor profundidad por científicos posteriores como Thompson y Rutherford, quienes sentaron las bases para la química contemporánea.
La definición de molécula fue cambiando a medida que avanzó la tecnología y se hizo posible un estudio más detallado de la estructura atómica y molecular.
Tipos de moléculas

Las moléculas se pueden clasificar de acuerdo a varios criterios. Según el tamaño y la complejidad de su estructura, se clasifican en:
- Moléculas discretas. Tienen un número definido de átomos, ya sea de distintos elementos o del mismo, y pueden clasificarse a su vez según la cantidad de átomos de su estructura. Tenemos así moléculas monoatómicas (un solo átomo), diatómicas (dos átomos), triatómicas (tres átomos), tetraatómicas (cuatro átomos), etc. Por ejemplo, el dinitrógeno (N2) es una molécula diatómica.
- Macromoléculas y polímeros. Se trata de cadenas moleculares de gran tamaño, compuestas por repeticiones de moléculas más simples, unidas entre sí para lograr secuencias extensas y complejas, con propiedades nuevas y específicas. Estas macromoléculas son clave para el desarrollo de la química de la vida. Por ejemplo, el ADN y las proteínas.
Es importante aclarar que todos los polímeros son macromoléculas, pero no todas las macromoléculas son polímeros. Los polímeros son macromoléculas compuestas por unidades moleculares más simples llamadas monómeros, que se repiten en toda su estructura. Por otro lado, las macromoléculas son moléculas de gran tamaño que pueden tener o no una unidad monomérica que se repite.
Según su polaridad (separación de cargas en la estructura molecular), se clasifican en:
- Moléculas polares. Están formadas por átomos que tienen diferente electronegatividad. Los electrones se desplazan hacia el átomo más electronegativo, lo que genera una densidad de carga negativa sobre él y una positiva sobre el otro átomo. Esta separación de cargas sobre la molécula resulta en la formación de un dipolo eléctrico, es decir, la molécula queda con cierta carga eléctrica. Por ejemplo, el agua (H2O).
- Moléculas apolares. Sus átomos tienen una idéntica electronegatividad, sin desigualdades respecto a la atracción de los electrones por los núcleos atómicos. Estas moléculas no tienen una carga eléctrica asociada a la desigual distribución de sus electrones. Por ejemplo, el oxígeno molecular (O2).
Según el elemento químico predominante en su estructura principal, se clasifican en:
- Moléculas orgánicas. Su estructura principal está basada en átomos de carbono. Son esenciales para la vida. Por ejemplo, el metano (CH4) y los aminoácidos (constituyentes de las proteínas).
- Moléculas inorgánicas. Su estructura principal no está fundamentada en el carbono. Es importante aclarar que también existen moléculas inorgánicas con átomos de carbono en su estructura, pero este no es su elemento principal. Por ejemplo, el monóxido de carbono (CO) y el amoníaco (NH3).
Propiedades de las moléculas

Las principales propiedades de las moléculas son:
- Polaridad. Es la separación de cargas eléctricas sobre la estructura molecular, debido a que los electrones son más atraídos por los átomos más electronegativos. Esta propiedad es fundamental para entender la solubilidad de las sustancias, pues sustancias polares se disuelven en sustancias polares, mientras que sustancias no polares se disuelven en sustancias no polares, aunque siempre existen puntos medios de polaridades.
- Temperatura de fusión. Temperatura a la que un sólido se transforma en líquido. Esta propiedad depende del tamaño de la molécula.
- Temperatura de ebullición. Temperatura a la que la presión de vapor de un líquido se iguala a la presión que rodea al líquido, entonces el líquido se transforma en gas. Esta propiedad depende del tamaño de la molécula, pero también de su geometría y de sus interacciones con otras moléculas.
- Volumen. Las moléculas ocupan un determinado volumen en el espacio.
- Reactividad química. Las moléculas son más o menos reactivas dependiendo de los átomos que las forman, de la geometría de su estructura y de las condiciones externas en que se encuentren.
- Isomería. Dos moléculas tienen isomería si tienen la misma cantidad de cada tipo de átomo, pero en cada una de ellas estos átomos están dispuestos de forma diferente. Es decir, poseen estructuras químicas distintas a pesar de tener la misma cantidad y tipo de átomos.
Fuerzas intermoleculares
Las fuerzas intermoleculares son interacciones que ocurren entre las moléculas. Generalmente están basadas en sus polaridades y su geometría. Estas fuerzas pueden ser de diverso tipo:
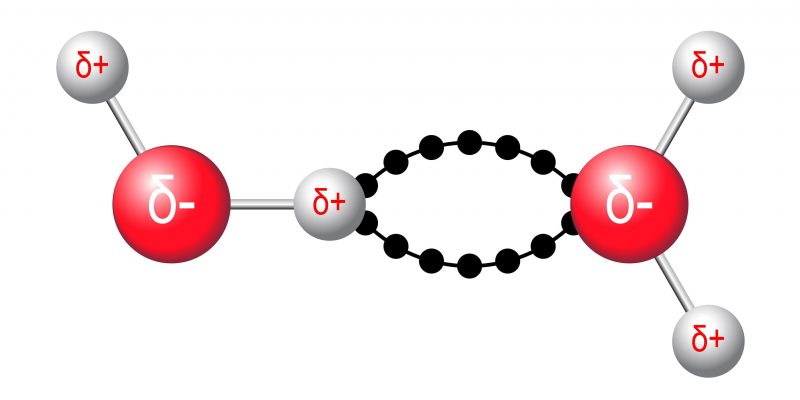
Fuerzas de Van der Waals:
- Dipolo permanente - dipolo permanente. Se dan debido a la atracción electromagnética entre dos moléculas polares..
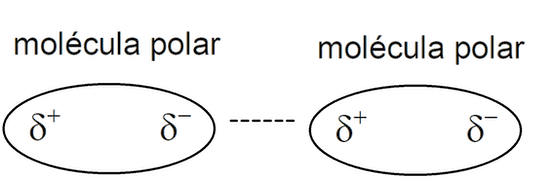
- Dipolo instantáneo - dipolo inducido. Llamados “Fuerzas de London”, son más débiles y tienen lugar entre todas las sustancias químicas, cuando su nube electrónica se desbalancea temporalmente hacia un extremo de la molécula, lo hace que pueda atraer o rechazar las nubes electrónicas de otras moléculas cercanas, y transformarlas por inducción en un dipolo momentáneo. Suelen darse entre moléculas no polares.
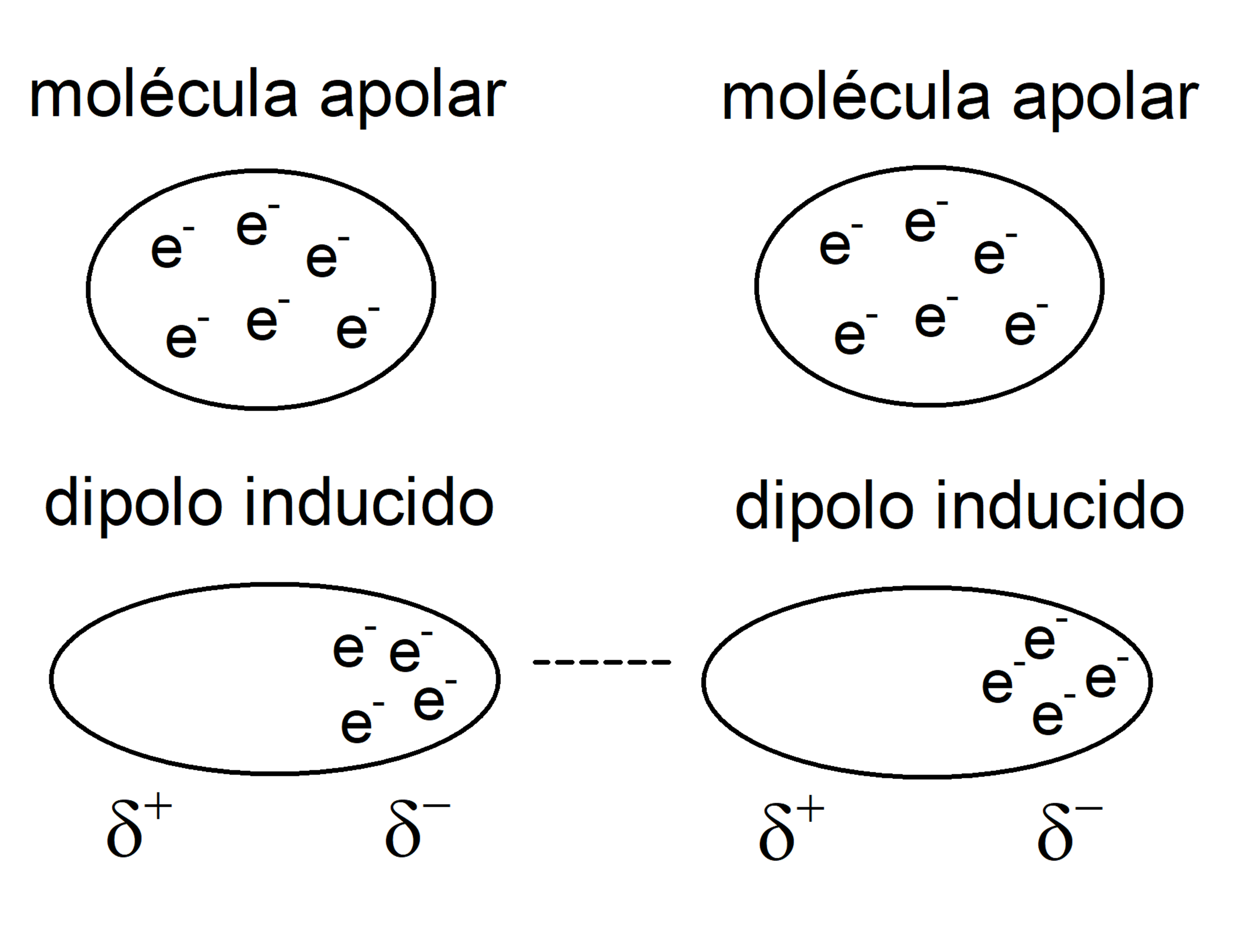
- Dipolo - dipolo inducido. Se dan entre una molécula polar y otra no polar. La densidad de carga de la molécula polar distorsiona la densidad de carga de la molécula no polar, e induce un dipolo.

Enlace por puente de hidrógeno:
Algunos científicos llaman a este tipo de enlace fuerza por puente de hidrógeno, definición que a veces se considera errónea. Pero independientemente de cómo se defina, es la interacción electrostática entre un átomo electronegativo de una molécula y un átomo de hidrógeno de la otra.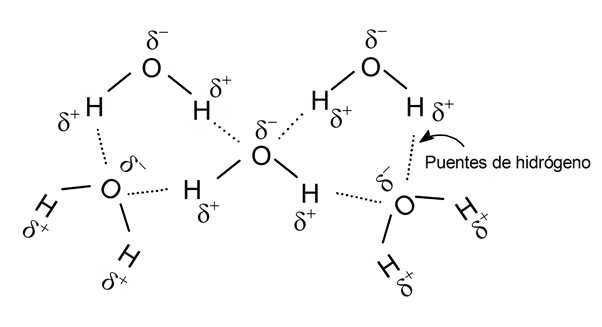
Diferencias entre iones y moléculas
Las moléculas y los iones se diferencian principalmente en que estos últimos constituyen unidades químicas cargadas eléctricamente, mientras que las moléculas son neutras.
La pérdida o ganancia de electrones de un átomo hace que se formen iones. Los iones pueden tener carga eléctrica permanente positiva si los átomos pierden electrones (cationes) o negativa si ganan electrones (aniones). Por ejemplo, el catión sodio (Na+) y el anión cloruro (Cl-).
Debido a esta carga eléctrica, la forma en que reaccionan los iones es muy distinta de como lo hacen las moléculas.
Por otra parte, también existen iones poliatómicos, que son agrupaciones de átomos que están enlazados mediante enlaces covalentes, pero que en su conjunto poseen carga eléctrica. Por ejemplo, el ion nitrato (NO3-).
Estabilidad molecular

La estabilidad química de las moléculas tiene que ver con la energía contenida en sus enlaces químicos y con su red molecular.
Mientras más energía tenga la molécula, será más reactiva y menos estable. Para romper los enlaces químicos, por lo general se consume energía y para formarlos casi siempre se libera energía.
Es por eso que las moléculas suelen poseer mayor estabilidad que sus átomos por separado. Y esa es también la razón por la cual los átomos tienden a juntarse con otros para formar moléculas.
Diferencias entre átomo y molécula
Las moléculas están formadas por átomos que están enlazados entre sí, de modo que los átomos son mucho más pequeños y sencillos que las moléculas.
Las moléculas más grandes están formadas por moléculas más simples y diminutas, que pasan a convertirse en partes o «grupos».
Por eso la mayoría de las moléculas puede someterse a diversos procedimientos de ruptura (lisis) de sus enlaces químicos, para obtener así moléculas más simples (de ser posible) o átomos pertenecientes a determinados elementos químicos.
Ejemplos de moléculas
Algunos ejemplos de moléculas comunes son:
- Hidrógeno: H2
- Ácido clorhídrico: HCl
- Dióxido de carbono: CO2
- Ácido sulfúrico: H2SO4
- Etanol: C2H5OH
- Ácido fosfórico: H3PO4
- Cloroformo: CHCl3
- Glucosa: C6H12O6
- Sacarosa: C12H22O11
- Acetona: C3H6O
- Celulosa: C6H10O5
- Amoníaco: NH3





¿Te fue útil esta información?
Sí No¡Genial! Muchas gracias por visitarnos :)