Te explicamos qué es el ácido sulfúrico, cómo es su fórmula y las propiedades que posee. Además, cuáles son sus características y usos.

¿Qué es el ácido sulfúrico?
Se llama ácido sulfúrico a un compuesto químico sumamente corrosivo. Es uno de los productos químicos más generados y empleados en el mundo entero, dadas sus numerosas aplicaciones en la industria y en la síntesis de otros insumos químicos.
Se lo conoce como ácido tetraoxosulfúrico (VI) o tetraoxosulfato (VI) de hidrógeno. Y está constituido por un átomo de azufre, dos de hidrógeno y cuatro de oxígeno. Se representa mediante la fórmula molecular H2SO4.
Ver además: Ácido clorhídrico
Historia del ácido sulfúrico
El ácido sulfúrico fue observado por primera vez en el medioevo musulmán, cuando los alquimistas lo obtenían a partir de cristales de sales de sulfato, material al que conocían como vitriolo, del latín vitreus (“cristal”). Por eso, tradicionalmente al ácido sulfúrico se le llamó aceite de vitriolo, licor de vitriolo o espíritu de vitriolo.
Según esta tradición, se suponía que el vitriolo era la sustancia química más importante del mundo, por lo que podía emplearse como piedra filosofal (sustancia que se suponía que podía convertir metales en oro o plata). Por esta razón, diversas sustancias se llamaban vitriolo azul o romano (sulfato de cobre II, CuSO4), vitriolo blanco (sulfato de zinc, ZnSO4), vitriolo verde (sulfato de hierro II, FeSO4), vitriolo rojo (sulfato de cobalto II, CoSO4) y vitriolo de Marte (sulfato de hierro III, Fe2(SO4)3).
La primera obtención de ácido sulfúrico en el mundo moderno tuvo lugar en el siglo XVII. El alemán Johann Glauber lo obtuvo quemando azufre con nitrato de potasio (KNO3). Su fabricación formalmente reconocida tuvo lugar en el siglo XVIII en Inglaterra, mediante un método conocido como “cámaras de plomo”.
Este método consistía en el lavado del dióxido de azufre (SO2) gaseoso caliente en diversos compuestos nitrogenados. Luego se disolvía en baño ácido para formar el ácido de torre o ácido de Glover.
Este último, entonces, pasaba a una serie de cámaras de plomo en las que era lavado con agua, posteriormente hervido y condensado en las paredes. Se trataba, sin embargo, de ácido de muy baja concentración en comparación con otros métodos actuales.
Propiedades del ácido sulfúrico

Propiedades físicas
- El ácido sulfúrico es un líquido aceitoso, incoloro y de olor particular, dependiendo de su concentración. Tiene un punto de fusión de 10 °C y un punto de ebullición de 337 °C.
- Su densidad es de 1,84g/cm3. Es miscible (soluble) con agua, pero genera calor, dado su enorme efecto deshidratante.
- Es muy polar y conduce muy bien la corriente eléctrica.
Propiedades químicas
- Es un oxidante fuerte.
- Reacciona con metales ordinarios, como el aluminio, para formar sulfatos y bisulfatos, además de liberar hidrógeno..
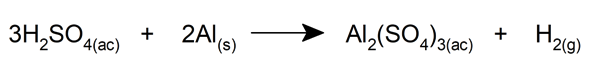
- Cuando está concentrado y a alta temperatura reacciona con carbono, fósforo y azufre. Además, en esta variante también puede reaccionar con metales preciosos.

- Descompone las sales formadas por otros ácidos.
Estructura química del ácido sulfúrico
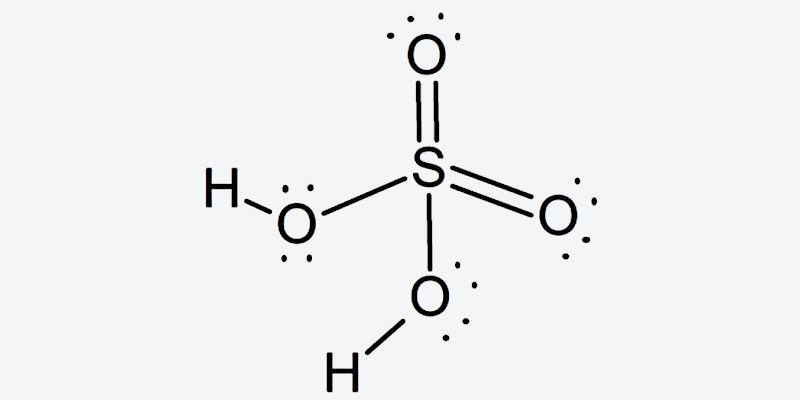
La molécula de ácido sulfúrico tiene una estructura piramidal, con el átomo de azufre en el centro y los cuatro átomos de oxígeno enlazados a este, ubicados en cuatro vértices. Dos de los átomos de oxígeno están enlazados al azufre mediante dobles enlaces, mientras que los otros dos mediante simples enlaces. En dos de ellos se encuentran, además, unidos los dos átomos de hidrógeno.
¿Cómo se obtiene el ácido sulfúrico?

Comúnmente, la obtención del ácido sulfúrico se realiza a partir de los siguientes métodos:
Método de contacto
En primer lugar, se obtiene el dióxido de azufre (SO2) a través de la combustión del azufre con el oxígeno o tostando minerales como la pirita. Después, se oxida el dióxido de azufre para obtener trióxido de azufre (SO3).
Luego, se hace pasar el trióxido de azufre por mecanismos de enfriamiento y luego por una torre de absorción, donde se lo hace reaccionar con una muestra de ácido sulfúrico concentrado, que resulta en ácido pirosulfúrico (H2S2O7)
Este ácido es luego descompuesto mediante su reacción con agua, dando como resultado el doble de ácido sulfúrico. Esta cadena de reacciones se describe así: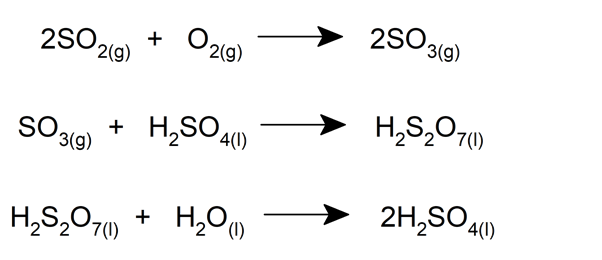
Nótese que no conviene diluir el trióxido de azufre directamente en agua, pues genera una reacción exotérmica tan violenta que la mayoría del compuesto se volatiliza antes de que pueda darse la formación de ácido sulfúrico.
Métodos de cámaras de plomo
El ácido sulfúrico utilizado para fabricar fertilizantes es producido principalmente por este método.
En este proceso, el dióxido de azufre entra a altas temperaturas por la parte inferior de una torre de Glover (un tipo de reactor químico), donde es lavado con una disolución de monóxido de nitrógeno (NO) y dióxido de nitrógeno (NO2) en ácido sulfúrico. Durante este proceso, una parte del dióxido de azufre se oxida a trióxido de azufre, que es lavado con ácido para formar ácido de Glover, un ácido que se forma en la torre y se compone de un 78 % en H2SO4.
Luego, la mezcla se pasa a una cámara de plomo, donde se trata con agua y se condensa el ácido sulfúrico en las paredes de la cámara.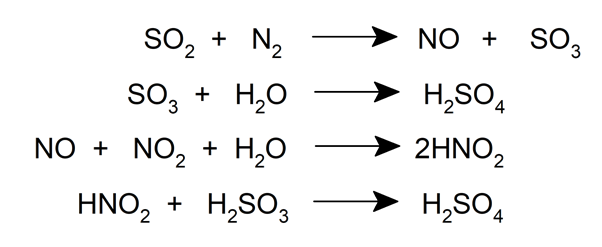
¿Para qué se usa el ácido sulfúrico?

Las aplicaciones del ácido sulfúrico son primordialmente en la industria química y petroquímica, como parte de la obtención de otros ácidos y bases. Es particularmente importante en la industria de los fertilizantes, así como en la refinación del petróleo, el tratamiento del acero, la manufactura de explosivos, detergentes y plásticos.
También es conocida su importancia en la industria maderera y del papel. Interviene también en muchos procesos de la industria textil y en la producción de baterías. En muchos países su comercialización se da bajo estricta vigilancia ya que forma parte de los químicos comúnmente empleados en la fabricación de cocaína.
Toxicidad del ácido sulfúrico
Queda claro que el ácido sulfúrico es un compuesto tóxico: un irritante de marca mayor, capaz de corroer materia orgánica con rapidez, cuando se encuentra en concentraciones elevadas.
Incluso en baja concentración, las exposiciones reiteradas pueden ocasionar dermatitis o incluso el cáncer. No existen niveles seguros de inhalación, ingestión o exposición por contacto a este compuesto.
Comercialización del ácido sulfúrico

El ácido sulfúrico es el producto químico más fabricado en el mundo, y sus ventas a lo largo del planeta son cuantiosas. Tanto es así, que en determinado momento se utilizaron sus márgenes de producción como método de medición del grado de industrialización de los países.
El precio del kilogramo puede oscilar entre decenas y centenas de dólares estadounidenses, dependiendo de su concentración.
Contaminación ambiental con ácido sulfúrico
El ácido sulfúrico no se encuentra usualmente en la naturaleza y, mucho menos, en altas concentraciones. Por ende, constituye un compuesto contaminante de gran impacto en la vida animal y vegetal, sobre todo si se considera su explosiva reacción con el agua.
Los derrames del material suelen tratarse con una base fuerte (como el bicarbonato) y contenerse mediante cenizas de cemento u otros materiales resistentes. Nunca se debe intentar diluirlo con agua, ni se lo debe tirar al desagüe o la alcantarilla.
Sigue con: Ácido acético
Referencias
- Hoja de Seguridad del Ácido Sulfúrico en la web del Instituto de Investigaciones Oceanológicas de la Universidad de Baja California. http://iio.ens.uabc.mx/
- “Ácido sulfúrico” en https://es.wikipedia.org/
- “Ácido sulfúrico” en https://acidos.info/
- “Sulfuricacid” en https://www.britannica.com/
- “Ácido sulfúrico” en https://quimica.laguia2000.com/
- “Tratamiento de ácido sulfúrico” en https://www.dedietrich.com/





¿Te fue útil esta información?
Sí No¡Genial! Muchas gracias por visitarnos :)