Índice
Te explicamos qué es el ácido acético, cómo es su fórmula y las propiedades que presenta. Además, sus características, usos y ejemplos.

¿Qué es el ácido acético?
Se llama ácido acético, ácido metilcarboxílico o también ácido etanoico a un compuesto orgánico que puede hallarse como ion acetato o etanoato ([C2H3O2]-). Está presente en el vinagre, líquido al que confiere su olor y sabor agrio característicos.
Se trata de un ácido débil, resultado usual en ciertos procesos de fermentación, como los que tienen lugar en el vino o en las frutas. Es muy usado en aplicaciones de la química orgánica y en diversos procesos industriales.
Su producción masiva en el mundo se debe a que es un compuesto útil en la obtención de otras sustancias orgánicas, como el ácido acrílico.
Fórmula del ácido acético
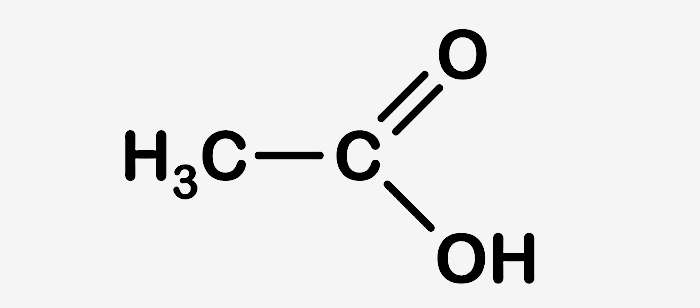
El ácido acético tiene la fórmula química C2H4O2 y la fórmula semidesarrollada CH3COOH. De allí se desprende que es un grupo metilo (CH3-) enlazado mediante un enlace simple de un átomo de carbono a un grupo carboxilo (-COOH).
Solubilidad del ácido acético

El ácido acético es una sustancia bastante polar debido a que tiene un grupo polar (-COOH), aunque también tiene cierto carácter apolar debido a su grupo (-CH3). Por la presencia de ambos grupos en su estructura, se trata de una sustancia que es soluble en agua (disolvente polar), pero también es soluble en muchas sustancias orgánicas menos polares.
Peso molecular del ácido acético
- Peso molecular. El ácido acético tiene un peso molecular de 60.05 g/mol.
- Densidad. La densidad del ácido acético es de 1049 kg/m3.
- Apariencia. Puede ser un líquido transparente con fuerte olor a vinagre y sabor ácido, o un sólido incoloro en forma de pequeños cristales regulares.
Vinagre y ácido acético

El vinagre contiene un 3 % a un 5 % de ácido acético disuelto en agua, junto a pequeñas cantidades de ácido tartárico (C4H6O6) y ácido cítrico (C6H8O7).
Se lo descubrió por vez primera en las labores del vino ya que las barricas pobremente custodiadas en las que se colaba el aire y el oxígeno, sufrían el proceso de fermentación de la bacteria Mycoderma aceti, que convierte el alcohol etílico en vinagre. Se decía entonces que el vino se “picaba”.
El vinagre, no obstante, forma parte importante de la gastronomía humana y se produce a partir de distintas fuentes: manzanas, uvas o alcoholes artificiales.
Es indispensable en la preparación de los escabeches, del ceviche, de los encurtidos, o como aderezo para las ensaladas. También se emplea en la conservación de los alimentos pues retarda los procesos de descomposición de la materia orgánica.
Propiedades del ácido acético
El ácido acético es un ácido bastante débil, a pesar de ser inflamable y corrosivo a la vez, así como una sustancia higroscópica (que absorbe agua de la humedad del ambiente).
En concentraciones altas puede, por ende, irritar la piel, los ojos o las mucosas, tanto por inhalación como deglución. Es un ácido a menudo segregado por los seres vivientes, como metabolito y sustrato de las enzimas acetiltransferasas.
Su punto de ebullición es 118 °C, mientras que su punto de fusión es 17 °C.
Ácido acético glacial

Se llama ácido acético glacial al resultado del congelamiento del ácido acético, en el que el agua que forma parte del compuesto forma cristales fácilmente retirables del compuesto. Una vez separados los cristales de agua de los cristales de ácido acético, se vuelve a pasar el ácido a estado líquido.
Así, cuando hablamos de ácido acético glacial, nos referimos a ácido acético anhidro, es decir, sin agua.
Peligrosidad del ácido acético
En líneas generales, el ácido acético con el que se tiene contacto en vinagre y otras soluciones se halla en tan bajas concentraciones que no es riesgoso en absoluto.
Sin embargo, en concentraciones altas, se trata de un ácido irritante capaz de causar quemaduras en la piel, daño permanente en los ojos, e irritación en las mucosas.
No es un compuesto particularmente inflamable, pero en soluciones a más del 25 %, sus gases pueden ser igual de corrosivos y peligrosos para la vida humana y animal, por lo que se maneja en una campana de extracción de humos.
Obtención del ácido acético
Algunas de las principales formas de obtener el ácido acético son mediante las siguientes reacciones:
- Carbonilación del metanol. Reacción entre el metanol y el monóxido de carbono que da como resultado ácido acético.
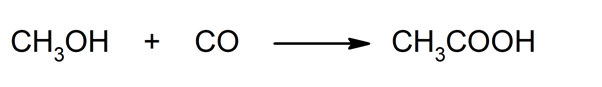
- Oxidación del etileno. Se oxida el etileno utilizando un metal como catalizador, paladio (Pd) en este caso.

- Fermentación oxidativa. En presencia de oxígeno, las bacterias del género Acetobacter pueden producir ácido acético a partir de ciertos compuestos alcohólicos.

Aplicaciones del ácido acético

El ácido acético tiene numerosas aplicaciones en las distintas industrias humanas, como por ejemplo:
- Se usa como aditivo en el control de las polillas de la cera (enfermedad llamada galleriosis) en la apicultura.
- Es un componente importante (formando sales o ésteres) para fabricar el nailon, rayón, celofán y otros filmes sintéticos.
- Se emplea en sustancias fijadoras para la preservación de tejidos orgánicos en laboratorios (como el formaldehído).
- Se emplea en los químicos para el revelado fotográfico.
- Se usa como tintura para revelar las lesiones del Virus del Papiloma Humano (VPH) en medicina.
- Es un componente usual de limpiadores y desmanchadores comerciales.
- Tiene muchos usos culinarios como vinagre: para lavar vegetales y hortalizas, como aderezo, etc.





¿Te fue útil esta información?
Sí No¡Genial! Muchas gracias por visitarnos :)