Te explicamos qué es el oxígeno, cuándo fue descubierto y cuáles son sus propiedades. Además, sus características, usos y más.

¿Qué es el oxígeno?
El oxígeno (O) es un elemento químico no metálico, normalmente gaseoso, sumamente abundante en nuestra atmósfera (integra el 20,8% de su volumen actual) en su forma molecular (O2) y el tercero más abundante del universo (luego del hidrógeno y el helio). Es indispensable para la vida tal y como la conocemos, en especial por su capacidad para formar junto al hidrógeno la molécula de agua (H2O).
El nombre del oxígeno proviene del griego antiguo oxys (“ácido”) y –gonos (“productor, generador”), es decir, significa “productor de ácidos” porque en aquellos tiempos se suponía erróneamente que los ácidos siempre contenían oxígeno en su estructura química.
Es muy reactivo, por lo que no suele encontrarse en su estado elemental (O), sino formando moléculas compuestas por sus mismos átomos o constituyendo compuestos químicos con otros elementos.
La molécula de oxígeno es usualmente diatómica (O2) a presión y temperatura ambiente o triatómica (ozono O3) bajo condiciones ambientales específicas. Por ejemplo, el O3 presente en la estratósfera se forma cuando los rayos ultravioletas rompen el O2, mientras que el O3 presente en la tropósfera se forma como resultado de las reacciones fotoquímicas entre compuestos orgánicos volátiles y óxidos de nitrógeno.
Como posee una reactividad muy elevada, se encuentran átomos de este elemento en numerosos compuestos orgánicos e inorgánicos del planeta, en los diversos estados de agregación de la materia. Se trata, pues, de un elemento sumamente común en el mundo y el universo conocido.
Ver además: Enlace químico
El oxígeno en la Tabla Periódica
En la Tabla Periódica el oxígeno se halla al inicio del grupo 16 (VIA), entre los elementos no metálicos conocidos como anfígenos.
Se representa con la letra O y en ese grupo está seguido por el azufre (S), el selenio (Se), el teluro (Te), el polonio (Po) y el livermorio (Lv).
El oxígeno tiene número atómico 8 y es el segundo elemento más electronnegativo de la Tabla Periódica (el flúor es el más electronegativo). Es uno de los elementos que se encuentra en estado gaseoso en condiciones de presión y temperatura ambiente.
¿Cuándo fue descubierto el oxígeno?
Aunque se conocían muchas de sus propiedades a partir del estudio del aire desde épocas antiguas, el oxígeno como elemento fue descubierto en 1772 por Carl Wilhelm Scheele. Este farmacéutico sueco notó, mientras quemaba óxido de mercurio, que se liberaba un “aire del fuego”.
Otros científicos del momento, como el clérigo británico Joseph Priestley, hicieron el mismo descubrimiento en experimentos análogos y le dieron el nombre de “aire desflogisticado”.
Más tarde, Antoine de Lavoisier se dedicó al estudio de la combustión y la oxidación, y descartó las teorías sobre el “flogisto”, que era una supuesta sustancia presente en todo lo combustible. Por el contrario, propuso la existencia de un nuevo elemento químico: el oxígeno.
En 1808 John Dalton elaboró su teoría atómica, donde plantea que todos los elementos químicos son monoatómicos y los compuestos se forman usando la menor cantidad posible de cada elemento. Según esta teoría, el agua tenía la fórmula HO (lo que es un error, la fórmula correcta es H2O).
Luego, en 1877, los físicos Raoul Pictet y Louis Paul Cailletet lograron obtener oxígeno líquido, aunque la cantidad que obtuvieron no fue suficiente para analizarlo. En 1891, el químico James Dewar logró obtener una adecuada cantidad de oxígeno líquido para su posterior estudio y en 1895 se desarrolló el primer método para producirlo con interés comercial.
Propiedades químicas del oxígeno

El oxígeno es una sustancia química sumamente reactiva, capaz de formar compuestos con casi todos los elementos conocidos con excepción del helio (He) y el neón (Ne). Es el principal de los anfígenos (formadores de ácidos y bases) y sus estados de oxidación son de -2 y -1.
Es un elemento que forma compuestos inflamables y es muy reactivo. En contacto con metales, forma óxidos y corroe las superficies.
- Forma óxidos con los metales alcalinotérreos.

- El aluminio en polvo arde de manera violenta en presencia de oxígeno.
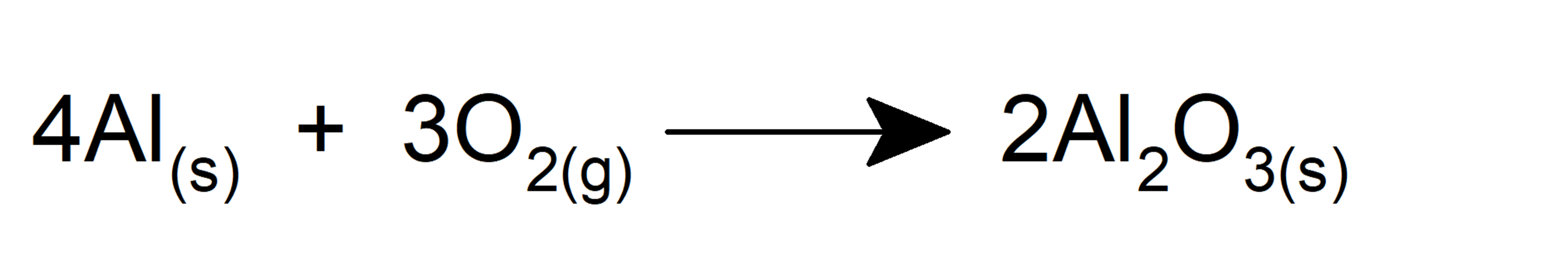
- Oxida al hierro formando el óxido de hierro (III).
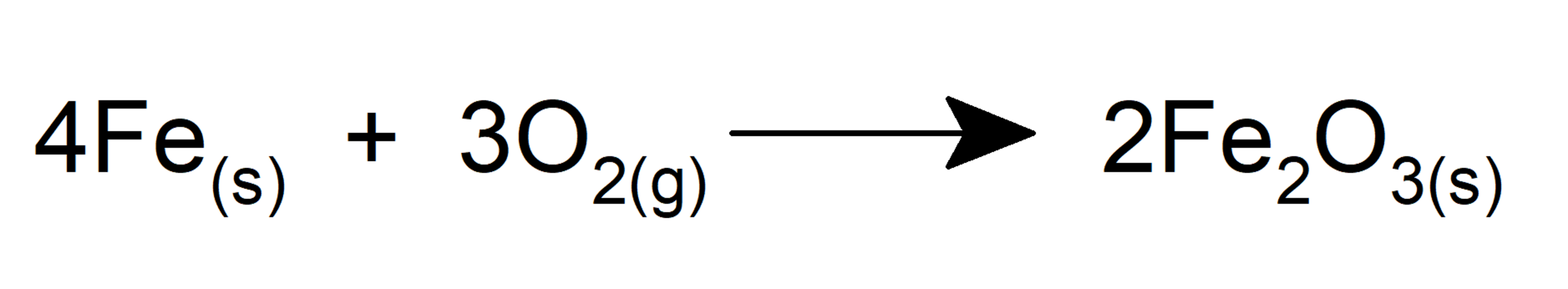
- Forma óxidos cuando reacciona con carbono.
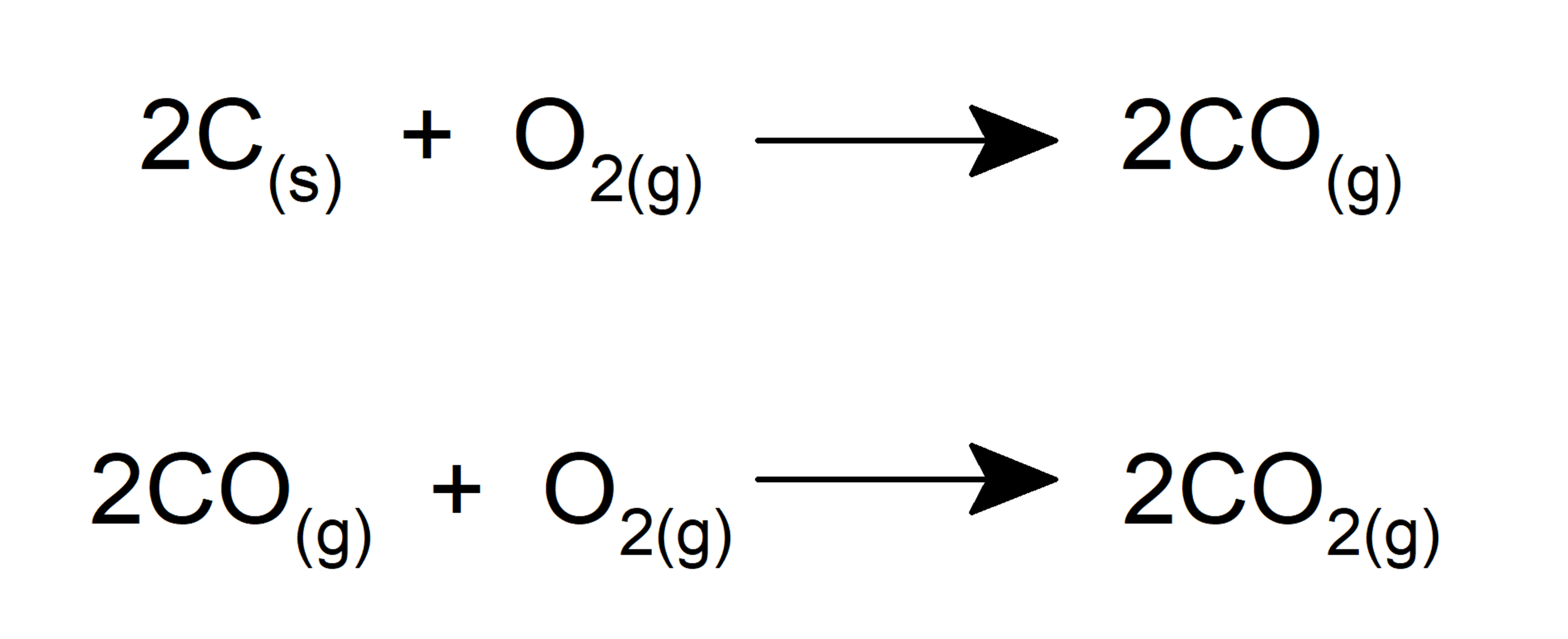
Propiedades físicas del oxígeno

En condiciones normales de presión y temperatura, el oxígeno se manifiesta como un gas incoloro, inodoro e insípido. Es mucho más soluble en agua que el nitrógeno: el agua dulce contiene alrededor de 6,04 ml de oxígeno por litro, mientras que el agua marina contiene 4,95 ml por litro.
Por otro lado, el oxígeno puede condensarse (pasar de gas a líquido) a -182,95 °C y congelarse a -218,79 °C, pasando a ser líquido y sólido respectivamente, con una coloración azul tenue.
Isótopos del oxígeno
El oxígeno tiene tres isótopos naturales y estables: 16O, 17O y 18O, de los cuales primero es el más abundante (99,762%).
Se sabe que existen 14 isótopos radiactivos del oxígeno, de los cuales el más estable es el 15O.
Importancia biológica del oxígeno
El oxígeno es fundamental en la vida. Forma parte de los azúcares y aminoácidos que componen las moléculas esenciales biológicas: carbohidratos, proteínas, grasas, etc. Además, constituye parte de las moléculas esenciales para el transporte de energía en el organismo de los seres vivos (ADP y ATP).
Por otra parte, el oxígeno es fundamental para la realización de la fotosíntesis de las plantas, las algas y ciertas bacterias. Para realizar este proceso, estos organismos utilizan el dióxido de carbono (CO2) del aire y la luz solar para transformar moléculas inorgánicas (como el CO2 y el agua) en carbohidratos, como la glucosa. Por último, el oxígeno es liberado al ambiente como un producto de esta secuencia de reacciones.

Gracias a este proceso, hace 2500 millones de años la atmósfera empezó a llenarse de este elemento. Muchas formas de vida anaeróbica en la época fueron eliminadas.
Por el contrario, los animales y otros seres vivos capaces de respirar necesitamos el oxígeno atmosférico para romper las moléculas de glucosa que obtenemos de la alimentación. Así obtenemos la energía necesaria para subsistir.
Durante este proceso, llamado respiración, los organismo aerobios toman el O2 del aire y liberan como subproducto CO2.
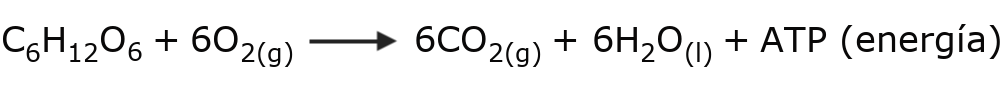
Aplicaciones del oxígeno
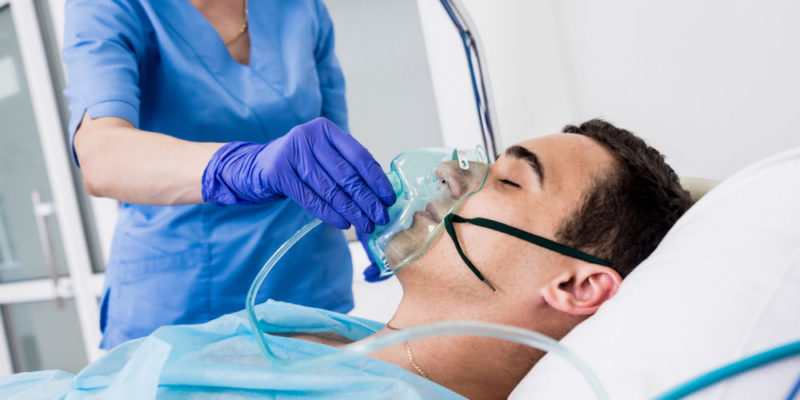
El oxígeno posee enormes aplicaciones en las industrias humanas, tales como:
- Usos médicos. El oxígeno se emplea como gas respirable en el mantenimiento con vida de pacientes quirúrgicos y como terapia (oxigenoterapia) para pacientes de afecciones cardíacas, pulmonares, etc. Ciertos isótopos del oxígeno como el 15O se ha usado para tomografías positrónicas.
- Apoyo vital. En las misiones espaciales y submarinas, el oxígeno gaseoso a baja presión se emplea como gas respirable para sostener los niveles de habitabilidad de trajes, naves y habitáculos.
- Usos industriales. El 55 % del oxígeno producido en el mundo en laboratorios se destina a ciertas aleaciones del hierro, como el acero. Otro 25 % se destina a la industria química, para crear óxido de etileno (C2H4O), base para la fabricación de numerosos materiales textiles y plásticos. Finalmente, se emplea también oxígeno para quemar acetileno y fabricar sopletes capaces de cortar metal con suma rapidez.
- Combustibles y purificadores. El oxígeno sirve también para oxidar el combustible de cohetes, para tratamiento de aguas residuales o, como ozono (O3) para purificadores de agua.
Producción industrial del oxígeno
La producción industrial del oxígeno se da principalmente a través de dos métodos:
- Filtrado del aire utilizando zeolita. Este método consiste en pasar aire limpio y libre de humedad a través de tamices moleculares de zeolita que retienen el nitrógeno (N2) y dejan pasar un aire cuyo contenido de oxígeno (O2) oscila entre 90 y 93 %. Este método se emplea para obtener oxígeno a baja escala.
- Electrólisis del agua. Este método consiste en la descomposición de la molécula de agua en hidrógeno y oxígeno mediante el uso de electricidad: el ánodo (+) atrae las moléculas de oxígeno gaseoso hacia un recipiente, y el cátodo (-) las de hidrógeno.
Compuestos inorgánicos del oxígeno

El oxígeno, debido a su alta electronegatividad, reacciona con otros elementos para formar óxidos. En los óxidos, el oxígeno tiene estado de oxidación -2, mientras que en los peróxidos tiene -1.
El compuesto inorgánico más habitual del oxígeno es el agua (H2O), pero existen muchísimos óxidos en los que se combina un elemento metálico, no metálico o metaloide con oxígeno. Por ejemplo: el dióxido de silicio (SiO2), presente en la arena y el granito; la alúmina (Al2O3) presente en la bauxita y el corindón; el óxido férrico (Fe2O3), en la hematita y el orín; etc.
Compuestos orgánicos del oxígeno
En la química orgánica, el oxígeno es un elemento común como parte de macromoléculas complejas, tales como los alcoholes (R-OH), éteres (R-O-R), cetonas (R-CO-R), aldehídos (R-CO-H) y ésteres (R-COO-R).. Por esta razón, muchos disolventes orgánicos tienen presencia fuerte de oxígeno.
Sin embargo, la mayoría de los compuestos orgánicos con oxígeno, a diferencia de los inorgánicos, no se produce por su acción directa, sino como parte de procesos químicos más complejos.
Riesgos en su uso

El oxígeno gaseoso (O2) puede ser un agente tóxico en el cuerpo humano cuando se halla a una presión mayor de 50 kPa. Es el tipo de presión a la que se someten los buzos y submarinistas de profundidad. Entre los síntomas de la intoxicación con oxígeno están las convulsiones, daños oculares, espasmos y daños neurológicos.
Por otro lado, al ser tan combustible, el manejo de oxígeno en concentraciones altas implica riesgos de estallido o incendio, dado que la molécula es propensa a una rápida combustión.
Sigue con: Gases
Referencias
- “Oxígeno” en https://es.wikipedia.org/
- “Oxígeno – O” en https://www.lenntech.es/
- “Características del oxígeno” en https://www.vix.com/
- “Oxygen (chemical element)” en https://www.britannica.com/
- “El oxígeno: molécula de vida, molécula de muerte” en diario El Nuevo Día. https://www.elnuevodia.com/





¿Te fue útil esta información?
Sí No¡Genial! Muchas gracias por visitarnos :)