Te explicamos qué es el hidrógeno y cuáles son sus propiedades atómicas y físicas. Además, sus características generales, usos y riesgos.

¿Qué es el Hidrógeno?
El hidrógeno es el primer elemento de la tabla periódica y el más abundante del universo conocido: constituye más de las tres cuartas partes de toda la materia observable. Es un elemento liviano, con la forma atómica más simple conocida, y usualmente se presenta como un gas diatómico (H2) incoloro, inodoro e inflamable.
El hidrógeno fue descubierto por el físico y químico británico Henry Cavendish en 1766 y forma la mayor parte de la masa de las estrellas en su fase inicial. Nuestro Sol, de hecho, es una enorme bomba de fusión de hidrógeno en el espacio. Según los expertos, el hidrógeno habría sido el primer elemento en constituirse de todos y es indispensable para la formación del agua (H2O).
Hoy en día, el hidrógeno es producido industrialmente y aprovechado en numerosas aplicaciones, desde el refinamiento de combustibles fósiles hasta la soldadura y la criogenia.
Ver además: Azufre
Características del hidrógeno
- Nombre. La palabra “hidrógeno” proviene de la unión de los vocablos griegos hydros (agua) y genos (nacimiento), por lo que etimológicamente quiere decir “que da origen al agua”. Obviamente esto alude a su participación en la molécula de este vital líquido, junto al oxígeno.
- Símbolo. El hidrógeno es el primer elemento de la Tabla Periódica, ubicado siempre en la esquina superior izquierda, encima del Litio. Se le representa mediante el símbolo H. Conviene destacar que el hidrógeno no posee características que le hagan fácilmente clasificable en los grupos de la Tabla, por lo que constituye casi siempre su propio grupo. Sin embargo, suele incluirse en la familia IA (Grupo 1).
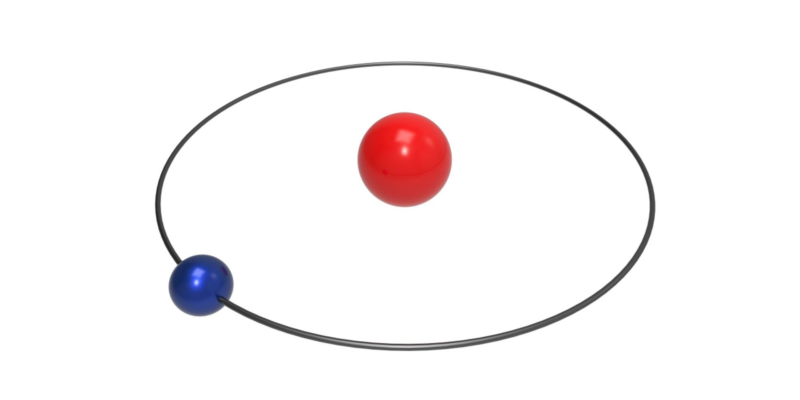
- Propiedades atómicas. El átomo de hidrógeno es el átomo más liviano conocido (masa atómica de 1,00794 u.m.a) y presenta un único electrón en su capa externa, por lo que su valencia es de 1. Es un átomo no metálico, altamente oxidable, con un único protón en el núcleo.
- Propiedades físicas. En condiciones ordinarias de presión y temperatura (1 atm y 25 °C), el hidrógeno se comporta como un gas incoloro e inodoro. Sin embargo, es posible licuarlo (llevarlo a líquido) a altas presiones, como ocurre en el corazón de las estrellas, o en los tanques de refrigeración en que se emplea hidrógeno líquido como refrigerante.
- Inflamabilidad. El hidrógeno en su forma diatómica gaseosa (H) es un gas muy inflamable, que reacciona de manera espontánea con elementos oxidantes como el oxígeno, cloro o flúor. Además, forma parte esencial de otras materias muy combustibles, como los hidrocarburos (hidrógeno y carbono), entre los que figuran los combustibles fósiles.
- Solubilidad. En su estado puro, el hidrógeno es insoluble en el agua. Pero, en cambio, puede disolverse en diversos metales, lo cual lo hace un elemento indispensable en la metalurgia. Es muy soluble en las tierras raras, en los metales de transición y en metales cristalinos y amorfos.

Abundancia del hidrógeno

El hidrógeno constituye más de un 70 % de la materia visible del universo, por lo que se trata del elemento más abundante de todos.
Se lo puede encontrar en el corazón de las estrellas jóvenes, en la atmósfera de los grandes planetas gaseosos (como Júpiter y Venus), como trazas en la superficie terrestre y también como parte de miles de compuestos orgánicos e inorgánicos en la naturaleza. Muchos procesos biológicos lo arrojan como resultado.
Isótopos del hidrógeno
El hidrógeno tiene varios isótopos (átomos de un mismo elemento químico, pero que tienen diferente cantidad de neutrones):
- Protio (1H). Compuesto por un protón y ningún neutrón en su núcleo. Es la versión más común del hidrógeno.
- Deuterio (2H). Más pesado que el hidrógeno común, su núcleo posee un neutrón junto al protón en su núcleo.
- Tritio (3H). Posee dos neutrones en su núcleo junto al protón, por lo que es aún más pesado.
Usos y aplicaciones del hidrógeno

Este elemento químico forma parte de un amplio rango de industrias, tanto en la química aplicada (hidrocarburos, fertilizantes, combustibles espaciales), la física (fusión controlada de hidrógeno para generar electricidad), y en otras áreas como la farmacología, el transporte (globos aerostáticos y zepelines), y los semiconductores.
Riesgos del hidrógeno
El manejo del hidrógeno en su estado puro es sumamente delicado, ya que su inflamabilidad representa un riesgo industrial importante, así como su capacidad de asfixiar mecánicamente al desplazar el oxígeno del aire. El hidrógeno líquido, potente enfriador, puede destruir también tejidos orgánicos.
Sigue con: Mercurio
Referencias
- Química General. Dr. sc. nat. Hans Rudolf Christen. Editorial Reverté S.A. 1977. ISBN: 84-291-7131-2
- Hydrogen Basics-Production. Florida Solar Energy Center. 2004.
- Hydrogen (H2) Properties, Uses, Applications. Hydrogen Gas and Liquid Hydrogen. Universal Industrial Gases, Inc. Universal Cryo Gas, LLC. 2017
- "Graf Zeppelin History" en Airships.net.
- "Hidrógeno" en Wikipedia.





¿Te fue útil esta información?
Sí No¡Genial! Muchas gracias por visitarnos :)