Te explicamos qué es el modelo atómico de Bohr, su origen y sus principales características. Además, los aportes clave de este modelo.

¿Qué es el Modelo atómico de Bohr?
Niels Bohr fue un físico danés que en 1913 propuso un nuevo modelo para explicar la estructura del átomo y su comportamiento a través de la estabilidad de los electrones. Por este decisivo aporte al conocimiento recibió el Premio Nobel de Física en 1922.
El modelo planteado por Bohr funcionó para comprender el funcionamiento de ciertos tipos de átomos, como el de hidrógeno, pero no para otros de estructura más compleja. Sin embargo, su modelo abrió las puertas para establecer las teorías siguientes y fue la base del modelo atómico moderno o de la actualidad.
Puede servirte: Modelo Atómico de Dalton
Origen del modelo atómico de Bohr
Durante la época de la antigua Grecia se pensaba que la materia estaba constituida por principios o elementos indivisibles, es decir, que no podían ser fraccionadas en partes aún más pequeñas (como el agua o el aire).
Sin embargo, el trabajo del químico John Dalton hacia finales de la Edad Moderna aportó los primeros enfoques científicos que sentaron las bases de la estequiometría química. En 1803 expuso su teoría atómica de que la materia estaba compuesta por átomos de diferentes estructuras.
En 1897 Joseph Thomson descubrió el electrón como parte del átomo y en 1911 Ernest Rutherford elaboró una teoría sobre la estructura interna del átomo. Niels Bohr fue quien comprendió y describió la organización de esas partículas llamadas electrones y su distribución en órbitas específicas alrededor del núcleo del átomo.
Características del modelo atómico de Bohr
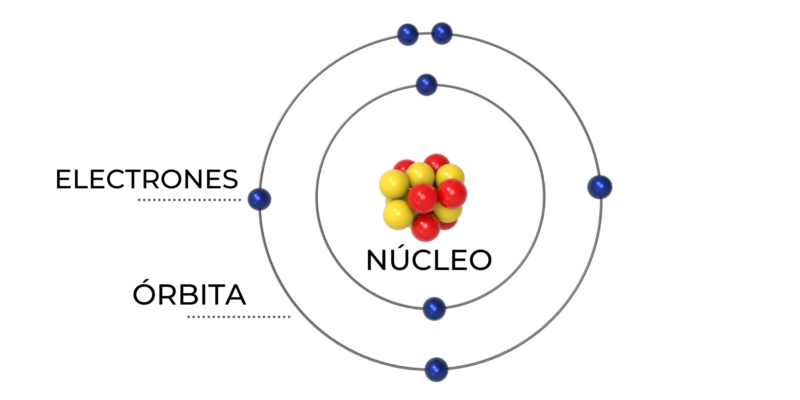
El modelo atómico de Bohr, que resultó la base del modelo atómico actual, explicaba la estabilidad de la materia y la conformación de los enlaces químicos. Observar la representación gráfica del modelo de Bohr hará más sencillo comprender las siguientes características:
- Los electrones que rodean el núcleo de un átomo pueden ser internos o externos. Ambos tipos de electrones se encuentran en órbitas circulares alrededor del núcleo, pero los electrones no pueden estar en todas las órbitas, solo en las permitidas.
- Los electrones están en niveles definidos de energía y a distancias fijas. La órbita más cercana al núcleo tiene energía más baja respecto a la órbita más alejada del núcleo, que tiene más energía.
- Las órbitas tienen un número determinado de electrones, según su distancia respecto al núcleo. Esa escala de distribución se denomina “configuraciones electrónicas” y es equivalente a la escala de la tabla periódica (representada en el orden de las filas).
- Los electrones pueden saltar de nivel o de órbita, y este salto solo puede ocurrir desde y hacia las órbitas permitidas. Por ejemplo, un electrón que salta de una órbita exterior a una interior pierde energía, que se desprende en forma de fotón o luz. Si salta de una órbita interior a una exterior, gana energía.
- La mínima cantidad de energía que se puede ganar o perder en cualquier longitud de onda se denomina “cuanto de energía”, de allí surge la expresión “salto cuántico” para hacer referencia a un cambio de los electrones de un nivel energético a otro. Este cambio está asociado a una pérdida o ganancia de energía.
Aportes principales de Bohr
El modelo de Bohr fue el primero en reconocer el concepto de la mecánica cuántica en la estructura electrónica de un átomo de hidrógeno y, además, develó cómo era la estabilidad de los átomos.
La teoría clásica sostenía que un electrón (con carga negativa) que orbitaba alrededor de un núcleo (con carga positiva) emitía energía electromagnética, y perdía velocidad hasta caer sobre el núcleo.
Pero las pruebas experimentales no evidenciaban el proceso planteado por la teoría clásica. A partir del modelo de Bohr y del trabajo de varios físicos más, lograron resolverlo.
En 1916 el físico alemán Arnold Sommerfel optimizó el modelo atómico de Bohr respecto a que los electrones giraban en órbitas circulares para agregar que, además, podían girar en órbitas elípticas más complejas.
Al concepto de mecánica cuántica propuesto por Bohr, se le agregó el modelo cuántico no relativista del físico austríaco Erwin Schrödinger, en 1926, cuya teoría contemplaba a los electrones como ondas estacionarias de materia que tenían probabilidad de estar en un lugar determinado o en otro.
En 1927 los físicos alemanes Max Born y Werner Heisenberg aportaron al concepto de probabilidad de Schrödinger el principio de incertidumbre, que establecía que no se podía conocer de manera simultánea la posición y la velocidad del electrón. Por lo tanto, no se podía saber su trayectoria con exactitud.
A través de estos aportes generales y de diversos estudios y teorías de otros físicos y matemáticos, se logró resolver el dilema planteado por la teoría clásica que resultaba incomprobable desde las pruebas experimentales.
Referencias
- “El modelo atómico de Bohr” (video) en Prueba T.
- “Modelo de Bohr del hidrógeno” en Khan Academy.
- “Las limitaciones del modelo de Bohr” en Cultura Científica.
- “ John Dalton” en Biografías y Vidas.





¿Te fue útil esta información?
Sí No¡Genial! Muchas gracias por visitarnos :)