Te explicamos qué son los estados sólido, líquido y gaseoso y las propiedades que poseen. Además, sus características y ejemplos.
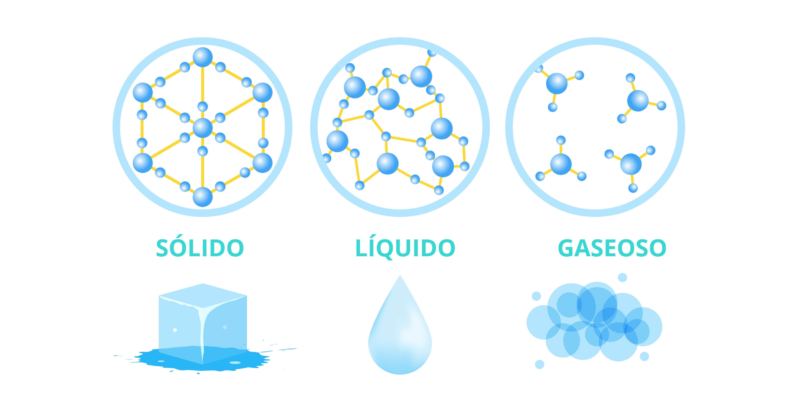
¿Qué son los estados sólido, líquido y gaseoso?
Cuando hablamos de estados de agregación de la materia, se trata de las formas en que la materia puede presentarse, dependiendo de la relación que haya entre las partículas que la componen. Se conocen generalmente tres, también referidos como fases: el estado sólido, líquido y gaseoso.
El estado de agregación determina las distintas propiedades físicas de la materia. Aunque las sustancias sean químicamente idénticas, las diferencias físicas son drásticas. Esto puede observarse, por ejemplo, en el agua, que puede ser líquida, sólida (hielo) o gaseosa. Aunque en todos los casos la composición química de agua sigue siendo la misma (H2O), físicamente se comporta distinto en cada estado.
También existen otros estados de agregación menos frecuentes. Entre ellos están el estado plasmático o los supersólidos, pero estas formas no se producen espontáneamente en la naturaleza, sino en laboratorios.
Ver además: Mezclas
El estado sólido

La materia en estado sólido presenta sus partículas muy unidas por fuerzas de atracción de gran intensidad. Las partículas están muy próximas unas a otras y vibran con lentitud.
Se comportan como un cuerpo único, con gran cohesión, mayor densidad que otros estados y una forma constante.
Los cuerpos sólidos son resistentes a la fragmentación y están dotados de memoria de forma, esto es, que tienden a permanecer siempre iguales a sí mismos.
Los sólidos tienen baja o nula fluidez, porque conservan su forma ante todo. En general no pueden comprimirse, ya que sus partículas están lo más juntas posible. Cuando se rompe o fragmenta un sólido, se obtienen nuevos objetos sólidos de menor tamaño.
Sigue en: Estado sólido
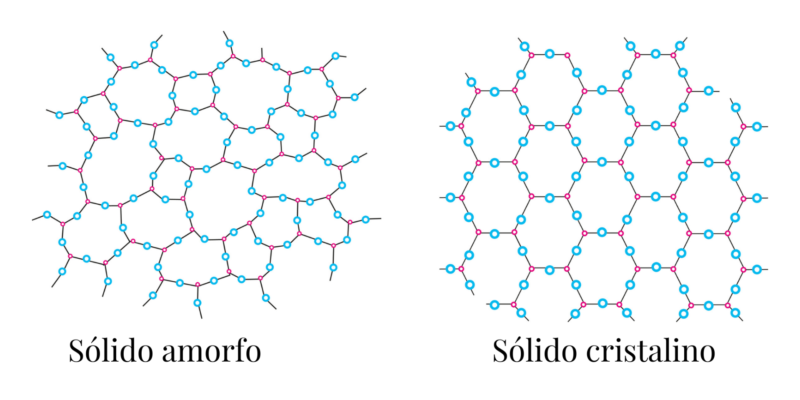
Tipos de sólidos y ejemplos

Existen dos tipos de sólidos, de acuerdo a la forma en que se ordenan sus partículas:
- Cristalinos. Se componen de celdillas organizadas de manera geométrica, por lo que suelen tener una forma regular, precisa, en base a un patrón. Por ejemplo: los metales, los compuestos iónicos como el cloruro de sodio (NaCl) y el diamante.
- Amorfos o vítreos. Como sus partículas no se juntan en una estructura ordenada o en un patrón determinado, su forma suele ser irregular y variada, conforme a las condiciones en que se produjeron. Por ejemplo: el vidrio y la goma.
El estado líquido

En el caso de los líquidos, sus partículas siguen estando unidas mediante fuerzas de atracción, pero son mucho más débiles y desordenadas que las de los sólidos. Por esa razón los líquidos no logran preservar una forma fija, ni estable, ni tienen tanta cohesión y resistencia como los sólidos.
Los líquidos obtienen la forma del envase que los contenga, aunque sus partículas no necesariamente se dispersan hasta ocupar todo su volumen, como ocurre en un gas. Por otra parte, tienen una gran fluidez, de hecho, pueden introducirse y extraerse por espacios pequeños. Su tensión superficial hace que se adhieran a los objetos, y esta es la razón por la que el agua moja.
Los líquidos son poco compresibles y tienen volumen propio. Además, con la excepción del agua, suelen contraerse cuando se los enfría.
Tipos de líquidos y ejemplos

Los líquidos son fluidos, así que se pueden clasificar de acuerdo a su fidelidad a los principios físicos descritos por Isaac Newton en sus estudios sobre la viscosidad. Pueden ser:
- Fluidos newtonianos. Cumplen con lo previsto por Newton, manteniendo su viscosidad constante. Se trata de los fluidos más sencillos de describir, que mientras más densos son, más lento fluyen. Por ejemplo: el agua, el queroseno, la gasolina y el alcohol.
- Fluidos no newtonianos. Se trata de un tipo especial de fluidos que no cumplen con las ecuaciones de Newton, pues su viscosidad u oposición al flujo varía con la variación de la temperatura, por lo que tienen solo una viscosidad aparente. Estos fluidos se obtienen casi siempre artificialmente. Por ejemplo: la brea, la lava, la sangre y el yogurt.
El estado gaseoso

Las partículas de los gases se encuentran en un estado caótico de dispersión y de alejamiento tal, que se mantienen juntas con dificultad. La fuerza de atracción entre ellas es muy débil, por lo que los gases ocupan un volumen mucho mayor que los líquidos y los sólidos.
Las sustancias en estado gaseoso tienden a expandirse hasta ocupar la totalidad del espacio que los contiene. Los gases además carecen de forma fija y también de volumen fijo y responden muy poco a la gravedad.
Más en: Estado gaseoso
Tipos de gases y ejemplos

Los gases se clasifican usualmente según sus propiedades químicas, que pueden ser muy diversas, por ejemplo:
- Gases inertes. Son gases dotados de muy poca reactividad química, como los gases nobles.
- Gases inflamables. Son gases de fácil combustión en presencia de oxígeno y calor, por lo que producen reacciones explosivas y exotérmicas.
- Gases corrosivos. Son gases que poseen una capacidad innata para generar corrosión, es decir, cuyo pH es tan ácido o tan básico que generan daño a las superficies por contacto.
Algunos ejemplos simples de gases son: el aire, el metano (CH4), el dióxido de carbono (CO2), el ozono (O3) y el helio (He).
Cambios de fase a sólido
Los cambios de fase son los procesos físicos que convierten a la materia de un estado a otro, sin alterar generalmente sus propiedades químicas. Los siguientes son los que convierten la materia desde líquido o gas a sólido:
- Solidificación. Es el proceso mediante el que, aumentando la presión de un líquido se lo convierte en sólido. Durante este proceso, las partículas del líquido se acercan, lo que provoca que se establezcan interacciones entre ellas que generan estructuras más firmes típicas de un sólido.
- Congelación. Consiste en la transformación de un líquido en sólido por enfriamiento del líquido. Es lo que ocurre al congelar el agua.
- Deposición. Es el proceso que consiste en retirar energía calórica a un gas, lo que puede hacer que, en condiciones de presión determinada, sus partículas se agrupen y pierdan su enorme velocidad, y se tornen en cristales sólidos sin pasar antes por el estado líquido. También se conoce como Sublimación inversa y suele ocurrir en la cumbre de las montañas, siempre cubiertas de hielo.
Cambios de fase a líquido

Los procesos de cambio de fase que conducen al cambio de sólido o gas a líquido son:
- Fusión. Es el proceso mediante el que se le aumenta la temperatura a un sólido hasta que se transforma en líquido. Se suministra energía calórica a la materia sólida hasta que su temperatura alcanza su punto de fusión, lo que hace que sus partículas ganen movimiento y velocidad, hasta hacerlo derretir, fluir y tornarse líquido. Es lo que se hace en la metalurgia con el hierro, que se calienta hasta que se funde.
- Licuefacción. Ocurre cuando se somete a un gas a presiones muy altas, forzándolo a transformarse en líquido, sin variar su temperatura. Así se consiguen los gases licuados, como el butano y el metano líquidos.
- Condensación. De nuevo, al retirar calor (enfriar) a un gas, se hace que sus partículas se muevan más lentamente. De esta forma se establecen interacciones entre sus partículas, y se forman gotas de líquido en cualquier superficie. Es lo que ocurre con el vapor de agua sobre el espejo al ducharnos.
Cambios de fase a gaseoso
Por último, los cambios de fase que conducen al estado gaseoso son:
- Ebullición. Se produce al introducir energía calórica a un líquido, de modo que su temperatura aumente más allá de su punto de ebullición: sus partículas empiezan a vibrar mucho más rápidamente y se agranda el espacio entre ellas, y se transforma la materia líquida en un gas. Podemos comprobarlo al hervir agua en la cocina.
- Evaporación. Es el proceso mediante el cual un líquido se convierte en gas cuando aumenta la temperatura del líquido y ocurre lentamente. No es necesario que la temperatura del líquido alcance el punto de ebullición para que comience a transformarse en gas.
- Sublimación. En ciertas condiciones de presión y temperatura, es posible movilizar velozmente las partículas de un sólido, para que se convierta en gas directamente, sin pasar primero por el estado líquido. Esto ocurre con el hielo seco (hielo de CO2) a temperatura ambiente.
El estado plasmático

Se conoce como plasma a un cuarto estado de agregación de la materia, que consiste en un gas ionizado. A los átomos de estos gases se les han retirado electrones y, por ende, tienen una carga eléctrica fija (aniones - y cationes +). Por esta razón el plasma es un excelente transmisor de la electricidad.
Existen dos tipos de plasma:
- Plasma frío. Los electrones se encuentran a mayor temperatura que los iones.
- Plasma caliente. Sus átomos ionizados se calientan enormemente, por lo que genera luz y calor.
Algunos ejemplos de plasma son el Sol, las pantallas electrónicas o el interior de los tubos fluorescentes de iluminación (como de neón).
Puede servirte: Separación de mezclas
Referencias
- “Estado de agregación de la materia” en Wikipedia.
- “Estados de la materia: sólido, líquido, gaseoso y plasma” en Portal Educativo, conectando neuronas.
- “Estados de agregación de la materia: sólidos, líquidos y gases” en Science Magic.
- “Phase (State of matter)” en The Enciclopaedia Britannica.





¿Te fue útil esta información?
Sí No¡Genial! Muchas gracias por visitarnos :)