Índice
Te explicamos qué es el agua y cuáles son las características de este solvente universal. Además, sus cambios de estado y propiedades.

¿Qué es el agua?
El agua (H2O) es la sustancia más abundante de nuestro planeta. Es una molécula formada por dos átomos de hidrógeno y uno de oxígeno. El término “agua” generalmente se utiliza para referirse al agua líquida, mientras que “hielo” se usa para referirse al agua en estado sólido y “vapor” para referirse al agua en estado gaseoso.
Se estima que el 71 % de la superficie terrestre está cubierta de agua, la mayor parte de esa cantidad está en los océanos. El agua también forma glaciares, casquetes polares, acuíferos, permafrost (la capa de suelo bajo la superficie de la Tierra que ha permanecido congelada), napas subterráneas, ríos, lagos y arroyos. Además, está presente en la humedad del suelo, en la atmósfera y es el componente central del cuerpo de los seres vivos.
La hidrósfera está formada por el agua que está por debajo y sobre la superficie sólida de la Tierra, y está constituida por ríos, lagos, agua subterránea, el hielo, la nieve, océanos y mares.
Casi todas las teorías sobre el origen de la vida en la Tierra plantean que la vida se originó en el agua. Diferentes estudios han mostrado que la vida surgió en aguas superficiales o en las profundidades de los mares.
Se estima que alrededor de un 25 % de las especies vivas que habitan el planeta Tierra tienen vida en el agua, y las bacterias son los organismos vivos más abundantes en medios acuáticos.
En el planeta Tierra el agua se mantiene en continua circulación mediante el ciclo hidrológico (o ciclo del agua) que es el conjunto de procesos mediante los cuales el agua circula entre los diferentes compartimentos de la hidrósfera.
Propiedades físicas del agua
- Es insípida. El agua no tiene un sabor determinado, por lo que al ser ingerida tendrá el gusto, en todo caso, de aquello que esté disuelto en ella, como puede ser azúcar o sal.
- Es transparente. El agua no tiene un color determinado y deja pasar los rayos de la luz a través de ella. Si está mezclada con otra sustancia que sí tiene color, entonces la mezcla toma el color de la sustancia disuelta.
- Es inodora. El agua no tiene olor. Si está mezclada con otra sustancia, la mezcla resultante tendrá el olor de la sustancia disuelta.
- Es conductora de electricidad. El agua conduce la corriente eléctrica siempre que tenga compuestos químicos disueltos en ella, que se disocian en sus iones (partículas con carga eléctrica) y generan la conducción de la corriente eléctrica. El agua pura, sin iones, no conduce la corriente eléctrica.
- Es magnética. El agua líquida y pura es diamagnética, es decir, es repelida por campos magnéticos externos intensos.
- Es incompresible. El agua líquida casi no puede comprimirse. Incluso a una profundidad de unos 2 kilómetros, sometida a 200 atm de presión, el agua disminuye su volumen solo en un 1 %.
- Transmite el sonido. La propagación del sonido en el agua ocurre casi sin atenuarse, sobre todo, las bajas frecuencias. Esta propiedad se utiliza en el funcionamiento del sonar y es la base de la comunicación entre los cetáceos.
- Presenta una alta tensión superficial. La cantidad de energía necesaria para aumentar la superficie de un líquido por unidad de área se denomina “tensión superficial”. Los líquidos con elevada tensión superficial, como el agua, ofrecen resistencia a aumentar su superficie. Por esta razón, los insectos pueden caminar sobre el agua.
Cambios de estado

El agua es líquida a presión y temperatura normales (1 atm y 25 °C). Se mantiene líquida entre 0 °C y 100 °C. A temperaturas menores que 0 ºC el agua se transforma en sólido (hielo) y a temperaturas mayores que 100 ºC, el agua se transforma en gas (vapor).
Si el agua se mezcla con otras sustancias, las temperaturas de ebullición y de congelación de la mezcla serán distintas a las del agua sin mezclar. Esto ocurre debido a las interacciones entre las moléculas de agua y las partículas de la sustancia disuelta.
La molécula de agua
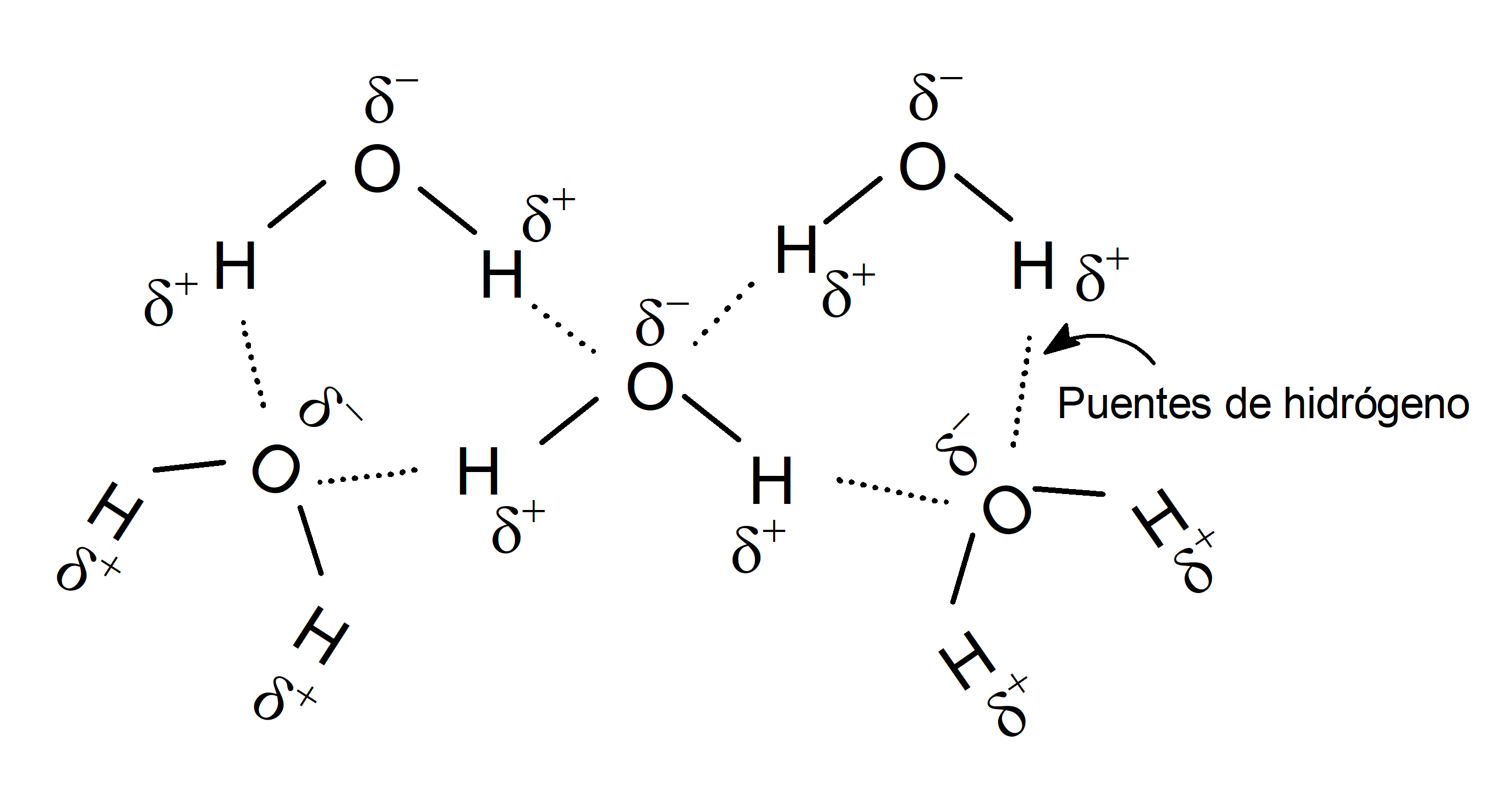
La molécula de agua está formada por un átomo de oxígeno y dos átomos de hidrógeno. Tiene geometría no lineal: el átomo de oxígeno está ubicado en el centro y los dos átomos de hidrógeno están formando un ángulo de 45º.

La geometría de esta molécula le da polaridad, es decir, la propiedad de separar las cargas eléctricas en la estructura molecular. Por esta razón, las sustancias que se disuelven en agua son polares o tienen una polaridad considerable.
Por otra parte, las moléculas de agua forman puentes de hidrógeno, que son las fuerzas electrostáticas de carácter atractivo que se generan entre un átomo electronegativo y un átomo de hidrógeno enlazado por enlace covalente a otro átomo electronegativo. En el caso de la molécula de agua, los puentes de hidrógeno se forman entre los átomos de oxígeno (electronegativo) y los átomos de hidrógeno.
Propiedades químicas del agua
- Se forma agua en las reacciones de combustión de compuestos orgánicos y en las reacciones de neutralización entre ácidos y bases.

- El agua reacciona con óxidos metálicos formando hidróxidos y con óxidos no metálicos formando oxácidos.

- El agua reacciona con elementos químicos muy electropositivos (elementos de los grupos IA y IIA de la Tabla Periódica) para formar hidróxidos.

- Los compuestos orgánicos e inorgánicos pueden hidrolizarse al reaccionar con el agua.
El agua como componente del cuerpo
El agua forma una gran parte del cuerpo de los organismos vivos. En el caso del ser humano, el agua constituye aproximadamente el 70 % de su cuerpo. En los seres vivos es imprescindible para la digestión, la absorción de nutrientes y la eliminación de desechos.
Debido a su capacidad de disolver muchos compuestos químicos, el agua juega un rol fundamental en las diversas reacciones químicas del metabolismo. Además, el agua sirve como medio de transporte de moléculas a través de la membrana celular.
Por otra parte, los productos de excreción de los organismos vivos se disuelven en agua para su mejor procesamiento.
Ciclo del agua en la naturaleza
El ciclo del agua en la naturaleza, también llamado ciclo hidrológico, es el proceso de circulación del agua a través de las distintas partes de la hidrósfera. La hidrósfera está formada por el agua que se encuentra sobre y por debajo de la superficie de la Tierra.
Durante el ciclo del agua en la naturaleza, el agua atraviesa diferentes procesos, y además, se transforma en distintos estados de agregación (líquido, sólido y gas). Así, los procesos del ciclo del agua son:
- Evaporación. Es la transformación del agua que forma los océanos, ríos, lagos y mares en vapor de agua. Este proceso ocurre cuando aumenta la temperatura.
- Transpiración. Es la formación de vapor de agua como consecuencia de la transpiración de las plantas y del sudor de los animales.
- Sublimación. Es la transformación del agua sólida en agua gaseosa. Este proceso ocurre en los glaciares, que están formados por agua sólida.
- Fusión. Es la transformación del agua sólida en agua líquida. Este proceso ocurre cuando aumenta la temperatura. Se puede observar cuando se derrite la nieve y se convierte en agua.
- Solidificación. Es la transformación del agua líquida en agua sólida (hielo). Este proceso se puede observar en las nubes, donde el agua se transforma en hielo cuando disminuye la temperatura, y luego precipita en forma de nieve o granizo.
- Condensación. Es la transformación del agua gaseosa de la atmósfera en pequeñas gotas, que luego forman las nubes.
- Precipitación. Es el proceso mediante el que, cuando disminuye la temperatura, las gotas de agua que forman las nubes se combinan entre sí. Esto provoca que se formen gotas más grandes que descienden hacia la superficie terrestre en forma de precipitaciones.
- Infiltración. Es el proceso mediante el que el agua que cae sobre la superficie terrestre debido a las precipitaciones, se convierte en agua subterránea cuando pasa por los poros de la superficie.
- Escorrentía. Es el proceso mediante el que, el agua que rebalsa de un depósito natural, se desliza por la superficie terrestre. El agua que se mueve por escorrentía es uno de los principales medios de transporte de sedimentos y nutrientes que necesitan para vivir las plantas y algunos animales.
Usos del agua
El agua debe ser usada de manera racional para evitar su contaminación, inutilización y agotamiento. Así, el agua se podrá usar de manera eficiente, lo que garantiza su calidad.
Los usos del agua se pueden clasificar en consuntivos y no consuntivos:
Usos consuntivos. Son aquellos en los que el agua es transportada desde una masa de agua principal hasta el lugar donde será usada. Luego esta agua (o al menos una parte de ella), no regresa al lugar del que salió.
Algunos usos consuntivos del agua son:
- Usos domésticos, como en la limpieza de hogares, en la elaboración de alimentos y en el aseo personal.
- Usos urbanos, como en la limpieza de comercios, escuelas, hospitales e instituciones públicas.
- Usos industriales, como en la producción de refrigerantes.
- Usos agrícolas, como en el regadío de cultivos y en la producción de fertilizantes.
Usos no consuntivos. Son aquellos en los que el agua se utiliza pero no se consume. El agua utilizada regresa al medio del que fue extraída, aunque no necesariamente al mismo lugar.
Algunos usos no consuntivos del agua son:
- Usos recreativos, como en en ríos, mares y lagos.
- Usos para la navegación, como en el transporte de mercancías y personas en barcos.
- Usos tecnológicos, como en la construcción de ecosistemas acuáticos.
Contaminación del agua
La Organización Mundial de la Salud (OMS) define el agua contaminada como “el agua cuya composición ha sido modificada de modo que no reúne las condiciones para el uso que se le ha destinado en su estado natural”.
La contaminación del agua provoca la inutilización y pérdida de fuentes y depósitos naturales de agua, que son utilizados por los seres vivos, tanto para su consumo, como para realizar otras actividades. Existen diversas causas de contaminación del agua, que pueden surgir de las distintas actividades realizadas por el ser humano, como de fuentes de contaminación naturales.
Tipos de contaminación del agua
Contaminación orgánica (eutrofización). Es la contaminación causada por el exceso de nutrientes y microorganismos. Este tipo de contaminación altera la composición natural del agua, aunque muchas veces no persiste en el tiempo y las modificaciones de la composición natural son reversibles.
Algunos factores que contribuyen a la contaminación orgánica son:
- El aumento de la cantidad de algas y organismos descomponedores.
- La presencia de microorganismos que proceden de desechos fecales.
- El aumento de la población de especies acuáticas que generan desechos como parte de su metabolismo.
Contaminación química. Es la contaminación causada por las actividades del ser humano. Este tipo de contaminación altera la composición natural, la estructura química y las propiedades del agua, y muchas veces no es reversible y persiste en el tiempo.
Algunos factores que contribuyen a la contaminación química son:
- El uso de pesticidas y fertilizantes en la agricultura, que luego pasan a las napas subterráneas de agua.
- Los derrames de productos tóxicos generados en actividades como la minería y la producción de materiales en plantas industriales.
- El vertido de desechos químicos a aguas de ríos y mares como resultado de la actividad petrolera y de la generación de energía eléctrica.
Sigue con:





¿Te fue útil esta información?
Sí No¡Genial! Muchas gracias por visitarnos :)