Te explicamos qué es la separación de mezclas y los métodos que utiliza. Además, cuáles son sus características generales y los tipos de mezclas.

¿Qué es la separación de mezclas?
La separación de mezclas o separación de fases es un proceso físico mediante el cual se pueden separar los componentes de una mezcla. Estos componentes no cambian durante el proceso de separación, sino que continúan siendo los mismos, solamente que luego de la separación los componentes se han separado.
La separación de mezclas es un proceso físico, no químico. Esto quiere decir que no se constituyen sustancias nuevas luego de la separación de las mezclas, como sucede en los procesos químicos, donde se combinan químicamente (se rompen y se forman enlaces químicos) dos o más sustancias para formar otras nuevas.
Existen diferentes métodos entre los que se destacan la filtración, decantación, destilación, evaporación, centrifugación, levigación, imantación, lixiviación selectiva, flotación y la cristalización, entre otros. La elección del método para la separación dependerá del tipo de mezcla que se desee separar ya que existen mezclas homogéneas y mezclas heterogéneas.
Ver además: Estados de la materia
Finalidades de la separación de mezclas

Las separaciones de las mezclas tienen diferentes finalidades u objetivos:
- Utilizar los componentes de una mezcla (homogénea o heterogénea) de manera individual en otros procesos.
- Cuantificar por separado las sustancias que las componen.
- Realizar combinaciones de los distintos métodos de separación para mejorar o facilitar la separación de mezclas complejas o difíciles de separar.
Fases de una mezcla

Existen al menos dos fases que componen las mezclas:
- Fase dispersa. Es la fase que se encuentra en menor proporción en la mezcla. Puede estar compuesta por una o más sustancias que se encuentran dispersas o disueltas en otra (fase dispersante). Por ejemplo, en una disolución de sal en agua, la sal es la fase dispersa o disuelta, mientras que el agua es la fase dispersante.
- Fase dispersante. Es la fase que se encuentra en mayor proporción en la mezcla. En ella pueden estar dispersas o disueltas una o más fases (fase dispersa). En el ejemplo anterior, la fase dispersante sería el agua, porque está en mayor proporción y contiene a la fase dispersa (la sal).
Tipos de mezclas
Existen dos tipos de mezclas:
- Mezclas homogéneas. Se caracterizan porque no es posible distinguir sus fases a simple vista (incluso con un microscopio). Las más comunes son las mezclas de sólidos con sólidos o de líquidos en líquidos. Por ejemplo: la lavandina (que puede contener diferentes cantidades de cloro), el café con leche, el azúcar en el agua, una limonada, la tintura de yodo, entre otras. Se las conoce como soluciones.
- Mezclas heterogéneas. Estas mezclas presentan discontinuidades, es decir, se pueden distinguir sus diferentes fases. Algunos ejemplos de mezclas heterogéneas son el cemento, el agua de mar, la arena en el agua, el agua y el aceite, el aceite y el vinagre. A su vez, se pueden dividir en:
- Mezclas simples o gruesas. Los componentes se pueden distinguir o diferenciar a simple vista. Por ejemplo, una ensalada de lechuga y tomate.
- Suspensiones. Las partículas de las sustancias sólidas son diminutas y no es posible reconocerlas a simple vista, pero cuando la mezcla está en reposo por determinado tiempo, es posible distinguirlas en el fondo del recipiente, pues descienden a través del líquido. Por ejemplo, una mezcla de agua y talco.
Ejemplos de mezclas en la vida cotidiana
En nuestras vidas estamos continuamente en contacto con distintas mezclas, ya sean homogéneas o heterogéneas. Por ejemplo:
- El agua de mar es una mezcla de cloruro de sodio (NaCl), agua y otros componentes.
- El hormigón o concreto, empleado en la construcción, es una mezcla de cemento, agua, arena y grava.
- Un café con leche, la base del desayuno de la mayoría de las personas, es una mezcla.
- El bronce, es una mezcla de cobre y estaño llamada aleación.
Diferencia entre mezcla y reacción química

Una mezcla es la combinación de dos o más sustancias, pero esta combinación no implica la formación de una o más sustancias nuevas, como ocurre en una reacción química. En una mezcla, las sustancias mezcladas mantienen sus propiedades químicas y su composición química sin cambio alguno.
Por otro lado, en una reacción química, las sustancias que reaccionan pueden romper sus enlaces químicos para recombinarse de otra manera con otras sustancias (que también rompieron sus enlaces) y así formar nuevos enlaces, lo que implica la formación de nuevos compuestos químicos.
Diferencia entre mezcla y compuesto químico
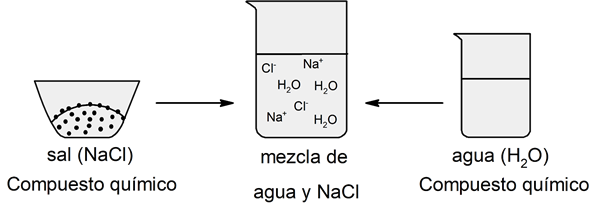
Los componentes de una mezcla pueden ser separados utilizando métodos físicos de separación, mientras que los elementos que forman un compuesto químico no pueden ser separados por estos métodos: para eso son necesarios métodos químicos de separación.
La razón de esto es que en las mezclas los componentes no forman enlaces químicos, mientras que los elementos sí forman enlaces químicos para formar determinado compuesto químico. Además, en los compuestos químicos estos elementos se enlazan en proporciones definidas, lo que permite representarlos mediante fórmulas químicas, mientras que las mezclas no se pueden representar de esta manera.
Propiedades físicas de las mezclas
Las propiedades físicas de las mezclas, como el punto de ebullición o el de congelación, pueden ser distintas de las de sus componentes por separado.
Por ejemplo, cuando al agua se le agrega sal de mesa (cuando contiene esta sustancia disuelta), aumenta el punto de ebullición de la mezcla y disminuye el de congelación, respecto a los del agua pura. Al primero se le llama aumento ebulloscópico y al segundo descenso crioscópico.
Algunos métodos de separación de mezclas
Los métodos de separación de mezclas son métodos físicos que se basan en alguna propiedad física de los componentes de la mezcla que se quiere separar, como por ejemplo, el punto de fusión, el punto de ebullición, el estado de agregación, el magnetismo, entre otras.
- Filtración. Se utiliza para separar un sólido de un líquido, siempre que el sólido sea insoluble en el líquido. Se usa un filtro por el que se hace pasar la mezcla, el sólido queda retenido en el filtro y el líquido lo atraviesa.

- Decantación. Se emplea para separar mezclas de dos líquidos insolubles entre sí o mezclas de un sólido y un líquido, también insolubles uno en el otro. Para lograr la separación, la mezcla se deja en reposo en un embudo de decantación, la sustancia más densa descenderá, mientras que la menos densa quedará en la superficie. Luego se abre la llave del embudo y se deja pasar a la sustancia más densa.
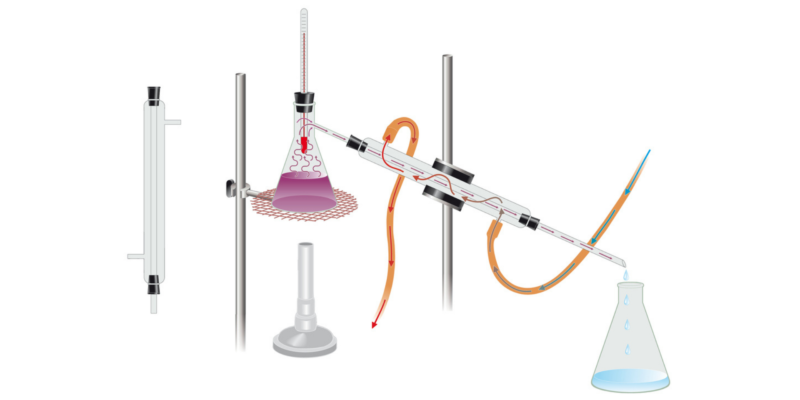
- Destilación. Este método sirve para separar mezclas de líquidos que son solubles entre sí. Está basado en las diferencias de puntos de ebullición de los distintos líquidos. Para separar la mezcla, primero se le aplica calor hasta que el líquido con menor punto de ebullición pasa a la fase vapor, y se condensa en otro recipiente. De esta forma queda separado del líquido de mayor punto de ebullición, que queda solo en el recipiente donde originalmente estaba la mezcla.
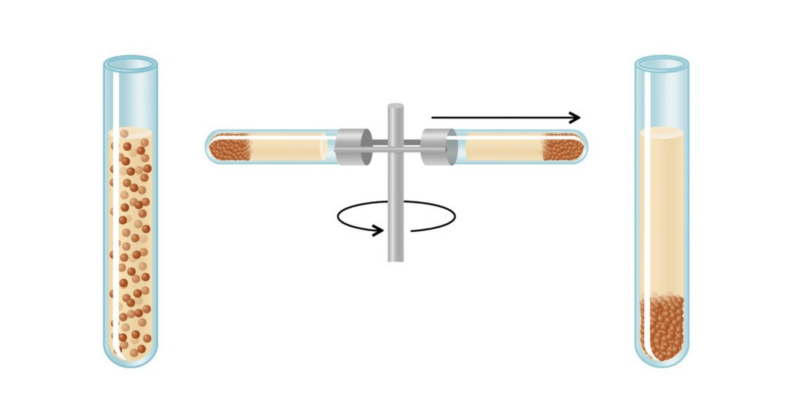
- Centrifugación. Se emplea generalmente para separar un sólido insoluble en un líquido. La mezcla se hace girar en una centrífuga (un recipiente que gira), provocando que la fuerza centrífuga envíe el sólido hacia el fondo del recipiente y dejando el líquido en la parte superior. Luego pueden separarse empleando decantación.
- Levigación. Se utiliza para separar mezclas de sólidos. Se trituran los sólidos y se les añade un disolvente. Luego esta nueva mezcla se puede separar según las distintas densidades de sus componentes.
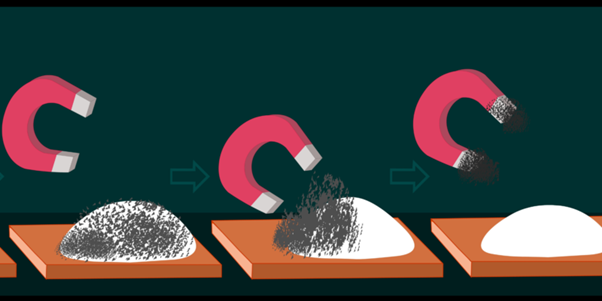
- Imantación. Consiste en separar una mezcla de sustancias en la que al menos una de ellas tiene propiedades magnéticas y puede ser atraída por un imán.
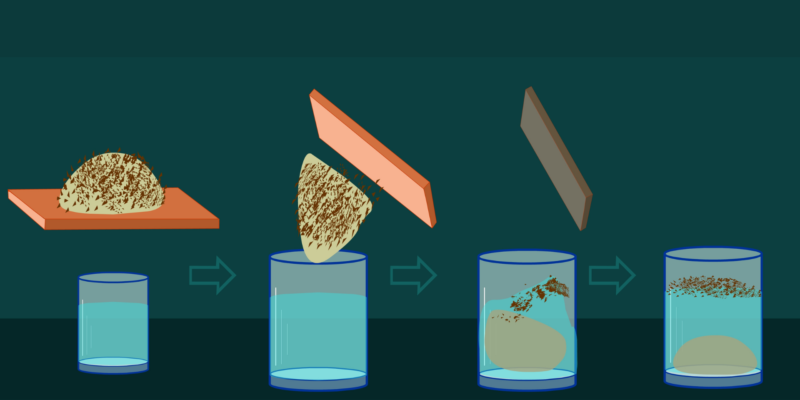
- Lixiviación selectiva. Es un método que emplea distintos disolventes para separar una mezcla. Cada componente de la mezcla tendrá más afinidad por un disolvente específico, por lo que al poner en contacto cada disolvente con la mezcla se separará el componente más afín con él. Este proceso es muy utilizado en la minería para extraer oro.

Puede servirte: Coloides
Referencias
- Métodos de separación de mezclas. metodosdeseparaciondemezclas.win
- Química I. Introducción al estudio de la materia. Ana Beatriz Picado y Milton Alvarez. Editorial Universidad Estatal a Distancia. 2008. ISBN: 978-9968-31-626-2
- Manual de Prácticas. Química General. María Rocio villa Gerley. 2007. ISBN: 958-98129-2-1
- "Mezcla" en Wikipedia.
- "Métodos de separación de fases" en Wikipedia.

¿Te fue útil esta información?
Sí No¡Genial! Muchas gracias por visitarnos :)