Te explicamos qué es el dióxido de carbono y cuáles son sus características generales. Además, sus propiedades, solubilidad y más.

¿Qué es el dióxido de carbono?
El dióxido de carbono es un gas que se obtiene como producto final de muchos procesos químicos y biológicos. Su concentración en la atmósfera es más bien baja, aunque ha aumentado mucho en los últimos años.
El dióxido de carbono está constituido por dos átomos de oxígeno y uno de carbono, de modo que su fórmula química es CO2. Esta molécula es de geometría lineal y simétrica, la estructura de Lewis que la representa es: O=C=O.

Ver además: Hidrocarburos
Estructura y fórmula del dióxido de carbono

Tal como su nombre lo indica, el dióxido de carbono está constituido por dos átomos de oxígeno y un átomo de carbono, por lo que su fórmula química es CO2. La molécula de dióxido de carbono tiene geometría lineal y simétrica. Antiguamente también se lo llamaba gas carbónico o anhídrido carbónico.
Características del dióxido de carbono
- Propiedades físicas. A temperatura ambiente y presión atmosférica, el dióxido de carbono es un gas incoloro e inodoro, pero puede solidificarse si se lo somete a temperaturas inferiores a -79° C, así como descomponerse si se expone a temperaturas altas (mayores de 2000 °C).
- Solubilidad y densidad. El dióxido de carbono es bien soluble en agua (cada volumen de agua disuelve 0,9 volumen de CO2) y su densidad es de 1,976 kg/m3.
- Efecto refrigerante. El dióxido de carbono en su forma sólida (que se consigue por exposición a bajas temperaturas) forma el hielo seco. Este es un refrigerante muy usado y eficiente, que al perder frío no se transforma en agua (como el hielo común) sino que se transforma en gas (pues a presión atmosférica es gaseoso), lo que tiende a minimizar las contaminaciones microbianas en productos frescos.
- Baja reactividad. Este gas no es combustible y, en general, es poco reactivo frente a otras sustancias, por lo que es ideal para ser usado en matafuegos o extintores domiciliarios. Al ser gaseoso, directamente es comprimido dentro del extintor y no requiere ningún mecanismo adicional de descarga. Además, no conduce la electricidad, y por eso sirve para apagar incendios en los que hay riesgo de descarga eléctrica.
- Acidez. El dióxido de carbono disuelto en agua destilada tiende a llevar el pH del agua destilada a un valor levemente ácido, debido a que se produce primero la formación de ácido carbónico (H2CO3) y luego del ion bicarbonato (HCO3-).

¿Cómo se forma el dióxido de carbono?

El dióxido de carbono se forma a partir de diversos procesos, se destacan entre ellos:
- Combustión. La combustión de materiales fósiles y no fósiles, como petróleo, carbón, gas, produce dióxido de carbono. Por ejemplo: la combustión del metano (CH4).
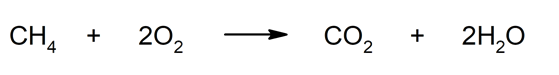
- Fermentación. La fermentación de azúcares que realizan bacterias y levaduras, por lo general conduce a la formación de ácidos y/o alcoholes y de CO2. Por ejemplo: la fermentación alcohólica.

- Respiración. La respiración de los animales consiste en tomar oxígeno y liberar dióxido de carbono. Por ejemplo: la respiración celular.
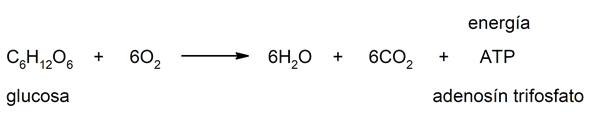
- Reacción de carbonatos con ácidos. Algunas sales, como los carbonatos, pueden reaccionar con ácidos y formar dióxido de carbono. Por ejemplo: reacción del carbonato de calcio (CaCO3) y el ácido clorhídrico (HCl).
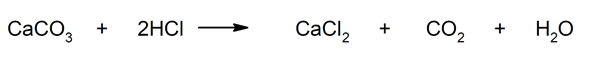
¿Para qué sirve el dióxido de carbono?
La fotosíntesis que realizan las plantas y algunos otros organismos fotosintéticos, como las algas, requiere CO2, de manera que estos seres consumen una buena parte del dióxido de carbono que hay en la atmósfera terrestre.
La fotosíntesis es un proceso muy importante ya que tiende a revertir en parte la creciente acumulación de dióxido asociada a la industrialización de los centros urbanos.
El dióxido de carbono y el efecto invernadero

El efecto invernadero consiste en la absorción de la radiación térmica que emite la superficie terrestre por ciertos gases. Luego, parte de esta radiación térmica es devuelta a la tierra, y calienta la superficie más de lo que debería.
La emisión de gases, entre ellos el dióxido de carbono, se ha incrementado de manera alarmante en el último siglo. Se estima que la concentración de CO2 en la atmósfera ha ascendido en casi 100 ppm en los últimos 150 años.
Esto se relaciona con el aumento de la temperatura de la Tierra y con una serie de daños concomitantes (fusión de los casquetes polares, cambios en la vegetación natural, cambios en las especies animales, etc.). La mayor parte de las emisiones de dióxido de carbono provienen de procesos industriales (principalmente de la quema de combustibles fósiles) que tienen lugar en los países desarrollados.
Más en: Efecto invernadero
Referencias
- Food Factories. https://legacyproject.org/
- Una verdad incómoda: La crisis planetaria del calentamiento global y cómo afrontarla. Al Gore. Gedisa Editorial. 2007.
- CO2. Wikipedia.

¿Te fue útil esta información?
Sí No¡Genial! Muchas gracias por visitarnos :)