Te explicamos qué es el modelo atómico de Dalton, cuáles son sus características principales y las limitaciones que presenta.

¿Qué es el modelo atómico de Dalton?
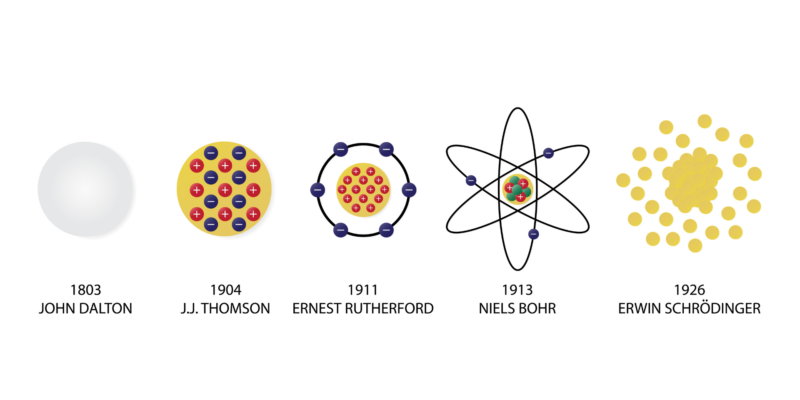
El modelo atómico de Dalton fue la primera conceptualización del funcionamiento, estructura y disposición de los átomos. Fue creado entre 1803 y 1807 por el científico inglés John Dalton, quien lo denominó en su momento como “teoría atómica” o “postulados atómicos”.
Esta elaboración teórica permitió brindar por primera vez una explicación satisfactoria tanto a la Ley de las proporciones constantes –que establece la proporcionalidad fija entre sustancias que reaccionan–, como a la Ley de las proporciones múltiples –que plantea que las proporciones entre sustancias que participan en una reacción química son siempre números enteros–. Además permitió explicar la existencia de numerosas sustancias elementales a partir de un conjunto finito de partículas constituyentes.
El modelo atómico de Dalton es un modelo combinatorio relativamente simple, que brindó explicación a casi toda la química de la época y que sentó las bases para futuros desarrollos e innovaciones en este y en muchos otros campos de la ciencia.
Ver además: Modelo Atómico de Bohr
Postulados del modelo de Dalton
- Primer postulado. El primer postulado de la teoría de Dalton estableció que toda la materia está formada por partículas elementales denominadas “átomos” y que no pueden ni ser divididas, ni pueden destruirse. Tampoco, según Dalton, no pueden crearse ni cambiar en reacción química alguna.
- Segundo postulado. Los átomos de un elemento cualquiera son idénticos entre sí, tanto en peso como en otras características; así, todos los átomos de oxígeno son necesariamente idénticos. En cambio, los átomos de elementos distintos se distinguen entre sí por su peso. De este postulado surgió la noción de peso atómico relativo, al comparar el de distintos átomos con el de hidrógeno.
- Tercer postulado. Los átomos no pueden dividirse, sin importar que se combinen como resultado de una reacción química. La combinación de átomos iguales o distintos generará compuestos o sustancias más complejos, pero siempre a partir del átomo como unidad mínima fundamental de la materia.
- Cuarto postulado. La combinación de los átomos de distintos elementos puede formar distintos compuestos dependiendo de las cantidades de estos elementos. Por ejemplo, el peróxido de hidrógeno (H2O2) está compuesto por dos átomos de oxígeno y dos átomos de hidrógeno, mientras que la molécula de agua está compuesta por un átomo de oxígeno y dos átomos de hidrógeno (H2O). Es decir, el oxígeno y el hidrógeno están presentes en estos dos compuestos químicos, pero en distintas proporciones.
- Quinto postulado. Los átomos de elementos distintos pueden combinarse en cantidades de dos o más para formar los distintos compuestos químicos.
- Sexto postulado. Los átomos no pueden crearse ni destruirse durante una reacción química.
- Séptimo postulado. Cuando los átomos se combinan para formar compuestos químicos, lo hacen en una proporción numérica simple, nunca fraccionaria.
Virtudes del modelo de Dalton
Son muchos los logros del modelo de Dalton, que significó el inicio formal de la química tal y como la entendemos hoy en día. La teoría atómica brindó un cauce a las preguntas de la química del siglo XVIII y XIX, y sentó las bases para la explosión posterior (en el siglo XX) que conduciría, de la mano de la tecnología, a nuevos descubrimientos en el entendimiento de la materia. La teoría de Dalton era simple, eficaz y avanzada para su época.
Limitaciones del modelo de Dalton

Era imposible que Dalton supiera en el siglo XIX lo que el siglo XX revelaría en materia de comprensión de los átomos, como por ejemplo que sí están constituidos de materia más pequeña y cargada eléctricamente: protones, neutrones y electrones. De hecho, los adelantos en energía atómica demostraron que el átomo efectivamente puede fisionarse y fusionarse.
Otra limitación importante tuvo que ver con la ausencia de conocimiento de los pesos atómicos, como lo estableció la tabla periódica (creada posteriormente por Mandeléyev y Meyer) y sus regularidades periódicas y propiedades químicas específicas. Esta limitante se debía a que Dalton creía que los compuestos químicos se formaban con la menor cantidad de elementos posible, es decir, que el agua estaba formada por un átomo de oxígeno y uno de hidrógeno (HO) y no por uno de oxígeno y dos de hidrógeno (H2O), como realmente es. Tampoco podía dar cuenta de la existencia de isótopos.
Por último, Dalton pensó que los gases estaban compuestos necesariamente de elementos simples y del mismo tipo de átomos. Esto lo llevó a contradecir los resultados de Gay-Lussac sobre las relaciones volumétricas, que resultaron ser comprobadamente ciertas.
Antecesores del modelo de Dalton
Hubo postulados semejantes en la antigüedad, principalmente los de los filósofos griegos Leucipo de Mileto (siglo V a. C.) y su discípulo Demócrito (siglo V - IV a. C), quienes prefirieron pensar las relaciones de la materia a partir de la física y no de la magia o la voluntad divina. Sin embargo, sus modelos atomistas no se sustentaban en la observación científica y la experimentación sino en los razonamientos lógicos.
Otro antecesor fue el irlandés Higgins, quien propuso una teoría semejante pero menos lograda en 1789.
Modelos posteriores
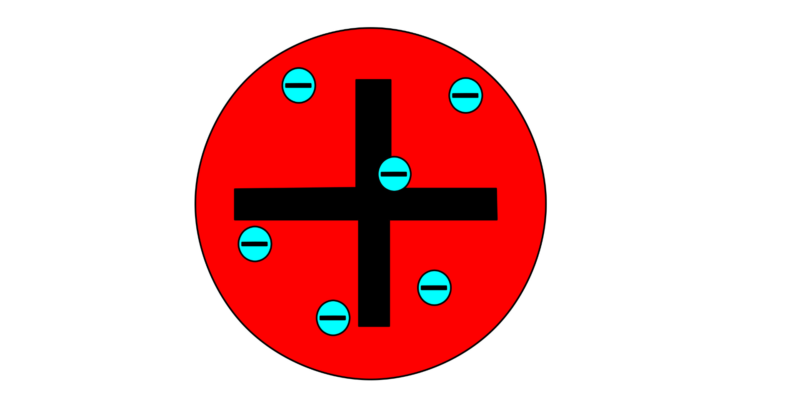
Otros modelos atómicos como el de Thompson (modelo conocido como “El budín de pasas”) fueron posibles gracias a los postulados de Dalton, a pesar de que su indivisibilidad del átomo fue contradicha por el descubrimiento del electrón a finales del siglo XIX.
En 1911, Rutherford propuso un modelo en el que el átomo está compuesto por un núcleo de carga positiva donde está la mayor parte de la masa del átomo, alrededor del que orbitaban electrones de carga negativa.
Luego, en 1913, Niels Bohr dio a conocer un modelo en el que los electrones orbitan alrededor de un núcleo positivo, pero solo lo hacen en ciertas órbitas permitidas.
A estos modelos atómicos le siguen modelos más modernos que son más específicos y cercanos a la realidad del átomo pero esto ha sido posible gracias al avance tecnológico.
Sigue con: Gases Ideales
Referencias
- Química 2. Pascual de Anda Cárdenas, Sandra Jara Castro, Ma. del Refugio Vivas Arceo, Herminia Flores de León y Ma. de los Ángeles Rodríguez Bautista. Editorial Umbral. 2007. ISBN: 978-970-9758-81-8
- Fundamentos de química. Burns, Ralph A. Pearson Educación. 2003. ISBN 9789702602811
- On the Structure of the Atom: an Investigation of the Stability and Periods of Oscillation of a number of Corpuscles arranged at equal intervals around the Circumference of a Circle; with Application of the Results to the Theory of Atomic Structure. J. Thomson, F.R.S.Philosophical Magazine. 1904
- "Modelo atómico" en Wikipedia.

¿Te fue útil esta información?
Sí No¡Genial! Muchas gracias por visitarnos :)