Te explicamos qué son los ácidos y bases y cómo pueden medirse estas sustancias. Además, cuáles son sus características y diversos usos.
¿Qué son los ácidos y las bases?
Los ácidos y las bases son sustancias que existen en la naturaleza y que se distinguen por su nivel de pH, es decir, por su grado de acidez o alcalinidad. Ambos, sin embargo, suelen ser sustancias corrosivas, a menudo tóxicas, que sin embargo poseen numerosas aplicaciones industriales y humanas.
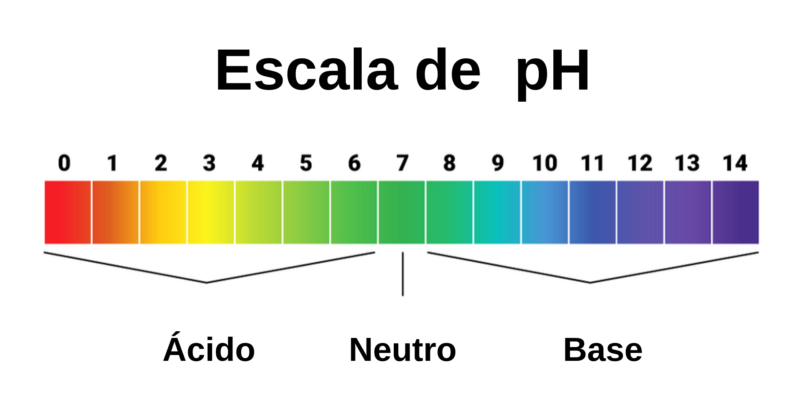
Los ácidos son sustancias de pH inferior a 7 (pH del agua igual a 7, considerado neutro), en cuya química figuran comúnmente grandes cantidades de iones de hidrógeno al añadirles agua. Suelen reaccionar ante otras sustancias perdiendo protones (H+).
Las bases, en cambio, son sustancias de pH superior a 7, que en disoluciones acuosas suelen aportar iones de hidroxilo (OH–) al medio. Suelen ser potentes oxidantes, es decir, reaccionan con los protones del medio circundante.
La reacción entre ácidos y bases se denomina neutralización y elimina más o menos las propiedades ácidas o básicas de ambos compuestos, produciendo agua y una sal en su lugar.
Ver además: Ácido acético
Características de los ácidos y bases

- Sabor. Las bases y los ácidos se distinguen fácilmente a través de su sabor. Las primeras tienen un sabor amargo característico, mientras que los ácidos suelen ser agrios, como el ácido cítrico del limón. Algunas bases menos intensas suelen mostrar sabores semejantes al jabón.
- Conductividad eléctrica. Tanto ácidos como bases, en disoluciones acuosas, son muy buenos conductores eléctricos. Eso se debe a su capacidad de generar iones cargados eléctricamente.
- Solubilidad. Los ácidos y las bases son solubles en agua, en líneas generales. Sin embargo, muchas bases fuertes como la sosa cáustica (NaOH) liberan una enorme cantidad de energía al hacerlo (reacción exotérmica) por lo que su contacto con este líquido es considerado de riesgo inflamable severo.
- Reactividad. Los ácidos y las bases se distinguen en que los ácidos ceden protones mientras que las bases aceptan protones de las sustancias que los acompañen. Esto significa que suelen reaccionar químicamente de maneras distintas ante sustancias como la materia orgánica, aunque en ambos casos el efecto visible sea de corrosión: tanto ácidos como bases pueden causar quemaduras graves a la piel, por ejemplo.
- Apariencia. Los ácidos presentan una consistencia aceitosa, mientras que algunas bases pueden tener un tacto jabonoso. Sin embargo, en estado sólido suelen ser más o menos porosos y frágiles, dependiendo de la sustancia específica. Algunos gases ácidos o básicos son incluso visibles a simple vista.

Neutralización
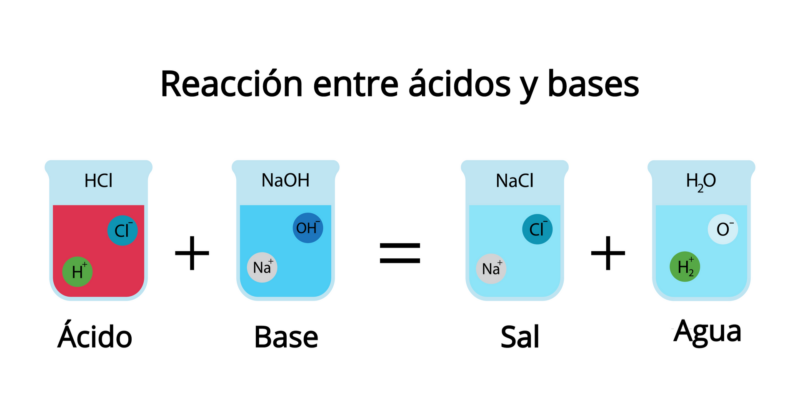
Al mezclar una base con un ácido, se produce un efecto de neutralización, en que los protones liberados por el ácido son aceptados por la base, y ambos pierden parte (o la totalidad) de sus propiedades ácidas o básicas.
Como producto de esta reacción se forma agua y algún tipo de sal, dependiendo del ácido y la base involucrados. Por eso, la sustancia resultante no es agria ni alcalina, sino salada. Por ejemplo: el ácido clorhídrico (HCl(ac)) reacciona con el hidróxido de sodio (NaOH) para formar la sal cloruro de sodio (NaCl) y agua (H2O).
Estados físicos

Tanto ácidos como álcalis pueden hallarse en cualquiera de los tres estados de agregación de la materia: sólidos (en polvo), gaseosos o líquidos.
Las formas gaseosas son las de mayor riesgo industrial y humano, ya que a menudo no pueden ser percibidas antes de inhalarse y hacer daños en el sistema respiratorio.
Medición del pH

Para medir el pH (acidez o alcalinidad de una sustancia en solución acuosa) de las sustancias se emplean indicadores ácido-base, que son sustancias, materiales o instrumentos de medición que sirven para medir la acidez o alcalinidad de un compuesto químico.
Existe un tipo especial de papel denominado papel tornasol azul, que cambia su color a rojo si se pone en contacto con un ácido y no le ocurre nada ante una base.
También existen sustancias líquidas como la fenolftaleína que se torna rosada si está en contacto con una base, e incolora si está en contacto con un ácido. Por otra parte, el anaranjado de metilo es un indicador de pH que tiene color rojo a pH menores que 3 y amarillo a pH mayores que 4.
Aplicaciones de los ácidos y las bases

Tanto bases como ácidos tienen numerosas aplicaciones industriales:
- Ácidos. Sus propiedades corrosivas son usadas para eliminar la herrumbre y otras impurezas de las sustancias industriales (como los metales). Además, se utilizan en reacciones químicas que permiten la obtención de electricidad (como en el caso de las baterías). Además, forman parte de fertilizantes y son a menudo empleados como catalizadores en reacciones químicas controladas, para obtener productos específicos en laboratorio.
- Bases. Se emplean a menudo como desecantes o productos para combatir la humedad ambiental, así como sustancias de limpieza y desinfección, tales como el jabón, el cloro de las piscinas, incluso el amoníaco. También se producen como fármacos para contrarrestar la acidez, como el bicarbonato de sodio, o purgantes como la leche de magnesia.
Nomenclatura

El nombre de los ácidos proviene del latín acidus, que significa “agrio”; las bases en cambio, denominadas álcalis, obtienen su nombre del árabe Al-Qaly, que traduce “ceniza”. En estos nombres puede observarse cómo el hombre ha lidiado con ellos desde edades antiguas, tratando de discernir unos de otros a partir de sus características.
Nomenclatura de los ácidos.
Oxácidos. Son ácidos que contienen oxígeno, un no metal e hidrógeno. Para nombrarlos, se utilizan prefijos y sufijos que dependen de la cantidad de números de oxidación que tenga el no metal. Por ejemplo:
- Si el no metal tiene cuatro números de oxidación:
- Para el menor número de oxidación. Se escribe la palabra ‘ácido’ seguida del prefijo ‘hipo-’ de la palabra que se refiere al no metal, seguida del sufijo ‘-oso’. Por ejemplo: ácido hipocloroso (HClO), el cloro tiene número de oxidación 1+.
- Para el número de oxidación siguiente. Se escribe la palabra ‘ácido’ seguida de la palabra que se refiere al no metal, seguida del sufijo ‘-oso’. Por ejemplo: ácido cloroso (HClO2), el cloro tiene número de oxidación 3+.
- Para el número de oxidación que le sigue. Se escribe la palabra ‘ácido’ seguida de la palabra que se refiere al no metal, seguida del sufijo ‘-ico’. Por ejemplo: ácido clórico (HClO3), el cloro tiene número de oxidación 5+.
- Para el mayor número de oxidación. Se escribe la palabra ‘ácido’ seguida del prefijo ‘per-’ de la palabra que se refiere al no metal, seguida del sufijo ‘-ico’. Por ejemplo: ácido perclórico (HClO4), el cloro tiene número de oxidación 7+.
- Si el no metal tiene dos estados de oxidación:
- Para el menor número de oxidación. Se escribe la palabra ‘ácido’ seguida de la palabra que se refiere al no metal, seguida del sufijo ‘-oso’. Por ejemplo: ácido sulfuroso (H2SO3), el azufre tiene número de oxidación 4+.
- Para el mayor número de oxidación. Se escribe la palabra ‘ácido’ seguida de la palabra que refiere al no metal, seguida del sufijo ‘-ico’. Por ejemplo: ácido sulfúrico (H2SO4), el azufre tiene número de oxidación 6+.
Ácidos binarios o hidrácidos. Son ácidos compuestos por hidrógeno y un halógeno (F, Cl, Br, I) o un elemento del grupo VI A de la Tabla Periódica que sea distinto del oxígeno (S, Se, Te). Se nombran poniendo la palabra ‘ácido’ seguida de la palabra que se refiere al nombre del no metal, seguida del sufijo ‘-hídrico’. Se debe poner el subíndice (ac) en su fórmula, que significa que están en solución acuosa. Por ejemplo: ácido clorhídrico (HCl(ac)), ácido bromhídrico (HBr(ac)) y ácido sulfhídrico (H2S(ac)).
Nomenclatura de las bases
La mayoría de las bases suelen llamarse hidróxidos, haciendo alusión al grupo funcional hidroxilo (OH-) que estos compuestos presentan. Se nombran escribiendo la frase ‘hidróxido de’ seguida del nombre del metal, seguido del número de oxidación del metal en números romanos y entre paréntesis (en caso de que tenga más de un número de oxidación). Por ejemplo: hidróxido de sodio (NaOH), hidróxido de magnesio (Mg(OH)2), hidróxido de hierro (II) (Fe(OH)2) e hidróxido de hierro (III) (Fe(OH)3).
Sigue con: Química orgánica

¿Te fue útil esta información?
Sí No¡Genial! Muchas gracias por visitarnos :)