Te explicamos cuáles son los metaloides y cómo son sus formas y coloración. Además, cuáles son sus características, propiedades y usos.
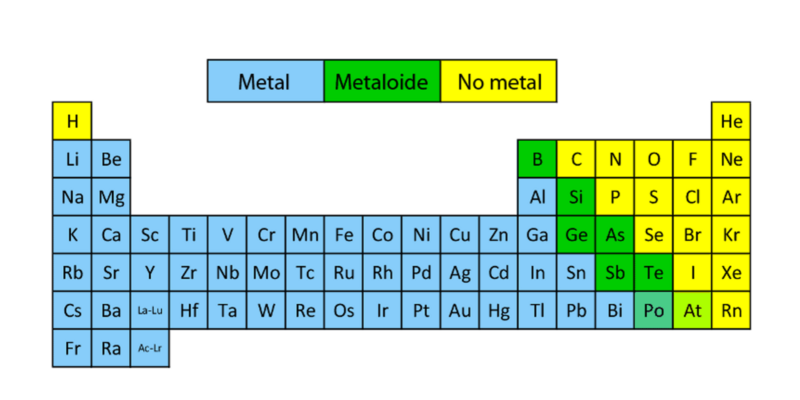
¿Qué son los metaloides?
Los metaloides o semimetales son un tipo de elementos químicos que muestran un comportamiento intermedio entre los metales y los no metales, en cuanto a energías de ionización y propiedades de enlace.
No es sencillo distinguirlos de los metales verdaderos. Conducen la corriente eléctrica mejor que los no metales, pero no son buenos conductores como los metales. Además, suelen ser muy variados en su forma y coloración.
La lista de los metaloides abarca los siguientes elementos:
- Boro (B)
- Silicio (Si)
- Germanio (Ge)
- Arsénico (As)
- Antimonio (Sb)
- Telurio (Te)
- Polonio (Po)
Ver además: Halógenos
Características de los metaloides

- Ubicación en la Tabla Periódica. Los metaloides se encuentran, dentro de la Tabla Periódica, en una diagonal descendente desde el boro hasta el polonio, esparcidos entre en las columnas 13, 14, 15 y 16, y dividiendo la tabla en dos. Los elementos que se ubican en la mitad de la derecha son no metálicos, y los que se ubican a la izquierda son metálicos.
- Forma y coloración. Los metaloides son muy variados en cuanto a su forma y su color. Pueden ser brillantes u opacos, y muchos de ellos presentan más de un estado alotrópico, es decir, distintas presentaciones de acuerdo a su estructura molecular. El arsénico, por ejemplo, puede ser gris, amarillo o negro, dependiendo de su forma alotrópica. El silicio, similarmente, puede mostrarse como un cristal sólido brillante o como un polvillo amorfo y amarronado.
- Conducción eléctrica. La mayoría de los metaloides son semiconductores (se pueden comportar como conductores o como aislantes, y transmiten la electricidad mejor en un sentido que en el otro) en lugar de conductores completos y en eso se distinguen de los elementos metálicos. No obstante, son mucho mejores conductores que los elementos no metales (aislantes), por lo que suelen ser utilizados en la industria de la fabricación electrónica.
- Conducción térmica. Los metaloides conducen la energía calórica mucho mejor que los elementos no metálicos, sin alcanzar la alta conductividad de los metálicos. En líneas generales, no se consideran buenos conductores del calor.
- Reactividad. Dada su condición intermedia, los metaloides reaccionan distinto dependiendo de si están en presencia de un elemento metálico (entonces reaccionan como un no metal) o un elemento no metálico (entonces reaccionan como un metal). Presentan afinidad por diversos elementos, dependiendo de cada uno, y por eso suelen hallarse en minerales junto con ellos, como el uranio, el plomo, el azufre, etc.
- Toxicidad. Si bien algunos metaloides son indispensables para la formación de moléculas vitales (por ejemplo el arsénico, que se encuentra en el cuerpo de los seres vivos), es posible que representen un peligro para la salud. La intoxicación por boro o por arsénico mismo (sumamente tóxicos) puede ser letal; y por su parte el polonio es un elemento tóxico y altamente radiactivo, es decir, que emite partículas alfa perjudiciales para la salud, al ser potencialmente cancerígenas, inmunosupresoras y mutagénicas.
Estados de agregación de los metaloides

La mayoría de los metaloides suele mostrarse en estado sólido a temperatura ambiente, ya sea en forma de cristales (como el arsénico) o de bloques opacos y quebradizos (como el germanio).
Sin embargo, algunos presentan propiedades curiosas en cuanto al cambio de fases. Por ejemplo, el arsénico pasa directamente de sólido a gas (sublimación) en presencia de calor (y a presiones atmosféricas normales).
Propiedades atómicas de los metaloides

Los metaloides son muy diversos en su caracterización atómica. Existen algunos con gran peso atómico como el polonio (209 u) o el antimonio (121,76 u), y otros más bien livianos como el boro (10,81 u) y el silicio (28,08 u).
Lo mismo ocurre con sus densidades, que van desde los 2,37 g/cm3 (boro) hasta los 9,32 g/cm3 (polonio) y con su configuración electrónica, que puede tener en la última capa distinta cantidad de electrones: 3 (boro), 4 (silicio, germanio), 5 (arsénico, antimonio) y 6 (telurio, polonio).
Abundancia de los metaloides
Algunos metaloides son sumamente abundantes en la corteza terrestre, como el silicio, que forma numerosos compuestos llamados silicatos, o el arsénico.
El boro, por su parte, existe abundantemente, pero como parte del mineral llamado bórax, ya que no existe en estado libre y puro en la naturaleza.
El polonio, en cambio, es bastante raro y aparece solo como parte de ciertos minerales de uranio; y el antimonio se encuentra en muy pequeños porcentajes en la corteza terrestre.
Usos de los metaloides

La mayoría de los semimetales son aprovechados para la fabricación de aparatos electrónicos y elementos semiconductores, como pueden ser los rectificadores, transistores, diodos, circuitos integrados o incluso (como en el caso del silicio), los chips y microprocesadores. Sin embargo, su variedad los capacita para numerosos usos distintos.
Por ejemplo, algunos isótopos del boro son útiles en la absorción de neutrones dentro de las centrales nucleares, y funcionan como mecanismos de regulación de las reacciones atómicas.
Sigue con: Gases nobles
Referencias
- Trace Elements in Human and Animal Nutrition. 5ta edición. Walter Mertz. 1986. ISBN: 9780124912526
- Principales compuestos químicos. Claramunt Vallespí Rosa M, Conargo Ramírez Pilar, Esteban Santos Soledad, Farrán Morales Angeles, Pérez Torralba Marta y Sanz del Castillo Dionisia. 2015. ISBN:978-84-362-6916-1
- "Semimetal" en Wikipedia.
- "Metaloide" en Quimica.es.

¿Te fue útil esta información?
Sí No¡Genial! Muchas gracias por visitarnos :)