Te explicamos qué es el átomo y cómo fue la historia de su descubrimiento. Además, cuáles son sus características principales.

¿Qué es el átomo?
El átomo es la partícula más pequeña en la que se puede dividir la materia.
Es importante aclarar que la definición de átomo muchas veces usa el término “partícula indivisible” para referirse a la partícula más pequeña que aún conserva las propiedades del elemento químico al que pertenece, pero el átomo está compuesto por partículas más pequeñas aún (protones, neutrones, electrones), pero que no tienen las propiedades del elemento químico.
Las primeras nociones de átomo surgieron a principios del siglo XIX, con los trabajos de Dalton, quien formuló la primera teoría atómica y describió por primera vez la existencia de partículas esféricas, minúsculas e indivisibles, que integran toda la materia y que son iguales entre sí en cada elemento químico.
A lo largo de todo ese siglo y a comienzos del siguiente el concepto se fue perfeccionando, de la mano de científicos como Thomson y Rutherford, hasta llegar a la formulación del modelo atómico de Böhr, propuesto por Niels Böhr y según el cual los electrones giran alrededor del núcleo en unos niveles de energía bien definidos.
Ver además: Modelo atómico de Dalton
Características del átomo

- Es una partícula muy pequeña. El átomo es la partícula más pequeña que mantiene las propiedades del elemento químico al que pertenece. Es la unidad más pequeña en la que se puede dividir la materia; de hecho, en griego la palabra átomo significa «no divisible», aunque este término no es del todo correcto, pues el átomo está compuesto por protones, neutrones y electrones.
- Es una partícula infinitamente liviana. La masa aproximada de los protones y de los neutrones es de 1,6726 x 10-27 kg y 1,6749 x 10-27 kg respectivamente; la de los electrones es aún menor: 9,1 x 10-31 Esto hace que los átomos sean sumamente livianos.
- Forma moléculas. Los átomos se agrupan para formar moléculas. Cada tipo de molécula es la combinación de un cierto número de átomos enlazados entre ellos de una manera específica, y una molécula puede contener átomos de diferentes elementos químicos o del mismo elemento.
- Es inalterable. Cada átomo conserva sus características estructurales, más allá de que formen parte de diferentes moléculas. Durante las reacciones químicas, los átomos no se crean ni se destruyen, pero se organizan de manera diferente creando enlaces entre un átomo y otro.
- Tiene una cantidad de protones fija. Lo que distingue a los elementos químicos entre sí (entre muchas otras características) es el número de protones que tienen sus átomos en el núcleo. El número de protones se representa con la letra Z y recibe el nombre de “número atómico”. La cantidad de protones coincide con la cantidad de electrones en un átomo eléctricamente neutro. El número atómico generalmente aparece en la tabla periódica de los elementos, ubicado arriba del símbolo químico, a la izquierda.
- Tiende a la inestabilidad. La tendencia normal de la gran mayoría de los átomos es a unirse con otros átomos (de su mismo tipo o diferentes) para formar agrupaciones estables (es decir, compuestos químicos) porque al hacerlo se llega a una situación de mínima energía y de máxima estabilidad. Al formar los enlaces químicos, ganan, pierden o comparten electrones. Estas uniones albergan energía que eventualmente se libera como calor o luz.
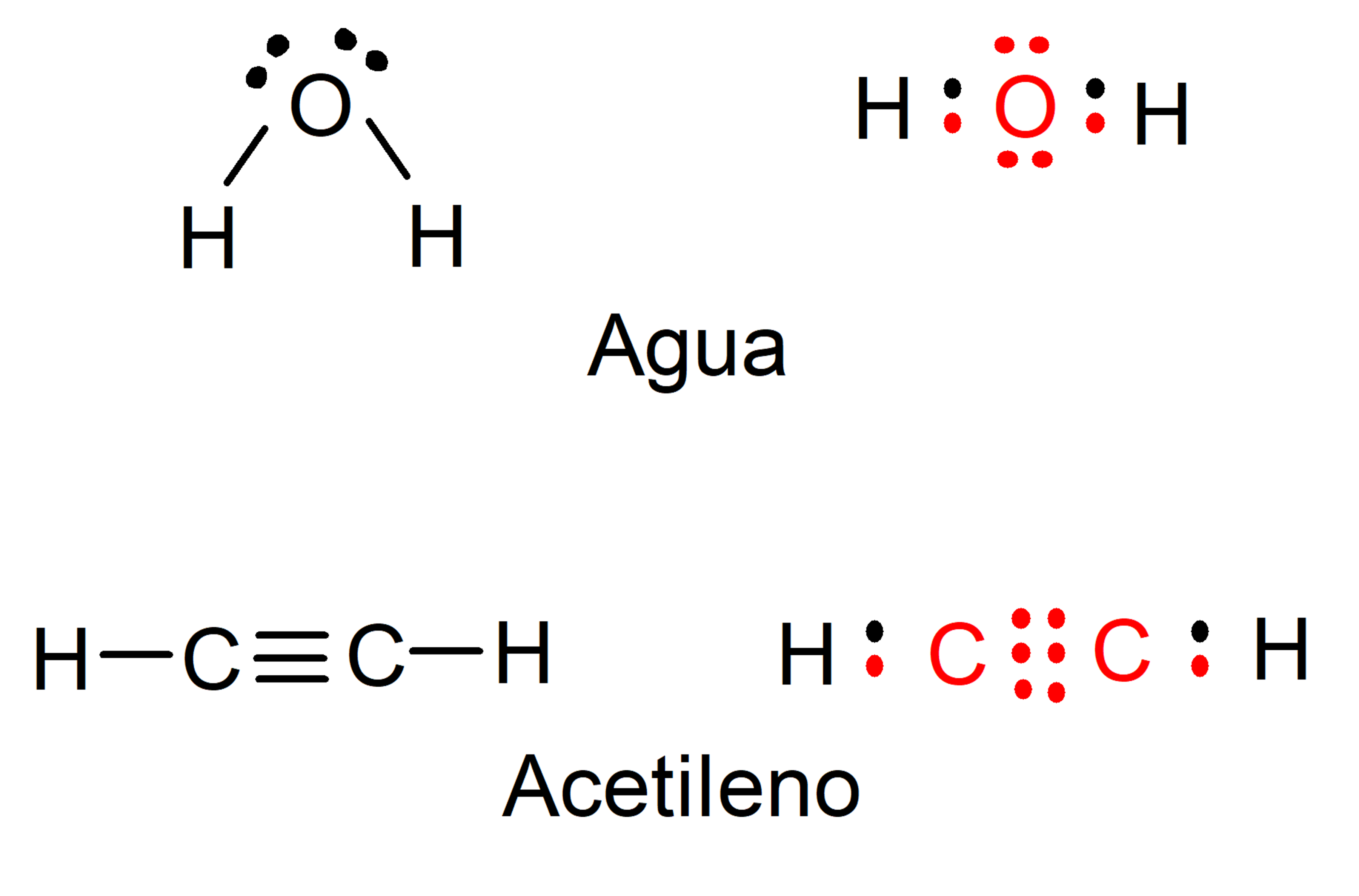
- Cumple con la regla del octeto. Lo que justifica la reactividad y formación de enlaces es que los átomos cumplen con la regla del octeto de Lewis, que indica que los enlaces responden a la necesidad de adquirir la configuración electrónica que caracteriza a los gases nobles o “inertes”, con ocho electrones ubicados en su último nivel de energía. Por ejemplo: la formación de las moléculas de agua y acetileno se pueden representar en el siguiente diagrama, donde los electrones del carbono y el oxígeno se representan en color rojo, mientras que los del hidrógeno se representan en color negro.
Estructura del átomo

El átomo está constituido por un núcleo central y una nube de electrones alrededor de ese núcleo. El núcleo contiene partículas con carga positiva llamadas protones y también partículas sin carga eléctrica conocidas como neutrones. La nube de electrones, de carga negativa, es atraída por los protones del núcleo mediante una fuerza electromagnética. A su vez, los electrones están caracterizados por orbitales atómicos, que son funciones matemáticas que representan la probabilidad de encontrar a un electrón en una región del espacio alrededor del núcleo.
Masa del átomo
La masa de un átomo está dada principalmente por la suma de los protones y los neutrones de su núcleo (ya que la masa de los electrones es infinitamente pequeña y por ende despreciable). Este parámetro se llama número másico y se representa con la letra A.
Aunque el número de protones es idéntico para todos los átomos de un elemento químico dado, el número de neutrones puede variar en algunos de esos elementos. Eso pasa, por ejemplo, con el carbono o el nitrógeno, que son elementos que presentan varios isótopos, como el llamado carbono -14 o el nitrógeno -15.
Los números másicos (suma de protones y neutrones) de estos dos isótopos son 14 y 15, respectivamente. Es decir, el carbono -14 tiene 6 protones y 8 neutrones, mientras que el nitrógeno -15 tiene 7 protones y 8 neutrones.
Reactividad química

Aunque los protones y los neutrones son importantes en términos de masa y de reacciones nucleares, son los electrones (sobre todo los del último nivel de energía de la nube electrónica) los responsables de la reactividad química de los átomos.
Son los electrones los que, en última instancia, van a permitir que se produzcan y descompongan todo el tiempo infinitos compuestos químicos. Es decir, los electrones son las partículas subatómicas que forman los enlaces químicos entre los átomos para formar los diversos compuestos químicos.
Puede servirte: Átomo de Carbono
Referencias
- El Átomo. Sokolovsky, Silvia. 2002
- Ciencias Naturales. Materia y entorno: la materia del universo. Francisco Soto, Alejandra Gallardo, Raúl Ladrón de Guevara y Judith Reyes. 2019
- Introductory nuclear physics. Kramer, Kenneth. ISBN 047180553X.
- Átomo. Wikipedia

¿Te fue útil esta información?
Sí No¡Genial! Muchas gracias por visitarnos :)