Te explicamos qué son las leyes de la termodinámica y cómo se desarrollan. Además, cuáles son sus características y ejemplos.
¿Qué son las leyes de la termodinámica?
Se conoce como leyes de la termodinámica o principios de la termodinámica a un conjunto de formulaciones que caracterizan a los sistemas termodinámicos a partir de sus cantidades físicas fundamentales: temperatura, energía y entropía.
Se denomina sistemas termodinámicos a una parte del universo que se aísla teóricamente para poder estudiarla.
Existen cuatro leyes de la termodinámica, enumeradas del cero al tres. En ellas se describe cómo operan dichos sistemas ante diversas circunstancias y contextos, y prohíben la existencia de algunos fenómenos, como el movimiento perpetuo. Se trata de las formulaciones más elementales de esta rama de la física.
Ver además: Ley de Murphy
¿Qué es la termodinámica?
La termodinámica es una rama de la física dedicada a la descripción de los estados de equilibrio de los sistemas físicos a nivel macroscópico, es decir, aquellos cuyas características son determinables por elementos internos y no por fuerzas externas que actúan sobre ellos. Por esta razón, considera que la energía solo puede intercambiarse de un sistema a otro en forma de calor o de trabajo.
Historia de la termodinámica
El primer principio termodinámico en establecerse fue formulado por Nicolás Léonard Sadi Carnot en 1824, y más tarde se conocería como la Segunda Ley de la Termodinámica. En la década de 1860, Rudolf Clausius y William Thompson (Lord Kelvin), expresaron formalmente este principio, junto con el que luego se convirtiría en la Primera Ley de Termodinámica. El tercer principio, más moderno, fue propuesto por Guggenheim y Fowler en 1930, y se lo denominó la “Ley Cero”, aunque no es reconocida como tal en todos los ámbitos.
Ley cero de la termodinámica
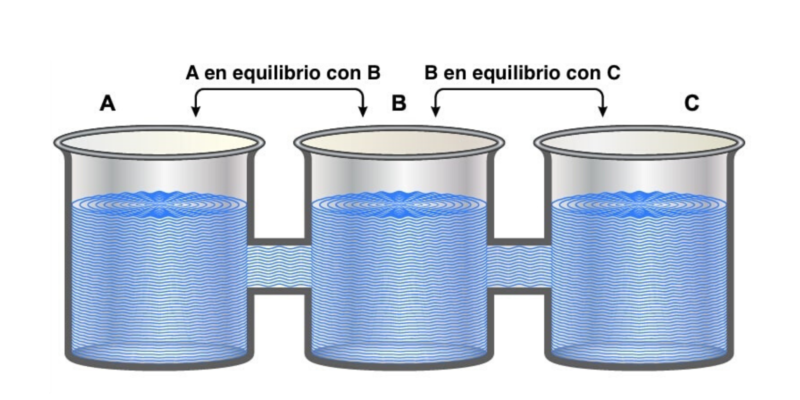
La “ley cero” es llamada así porque a pesar de haber sido la última en postularse, establece preceptos fundamentales para las otras tres. Indica que “si dos sistemas están en equilibrio térmico de forma independiente con un tercer sistema, deben estar también en equilibrio térmico entre sí”.
Esto puede expresarse lógicamente como que si A = C y B = C, entonces A= B.
Primera ley de la termodinámica
También conocida como la “Ley de la Conservación de la Energía”, establece que en cualquier sistema físico aislado, la cantidad total de energía será la misma a lo largo del tiempo, aunque pueda transformarse en otras formas de energía.
Dicho de otro modo: “en un sistema aislado, la energía no puede crearse ni destruirse, solo transformarse”.
Otra manera de enunciar esta ley es mediante la relación entre el calor (Q) que recibe o cede un sistema termodinámico, el trabajo hecho o recibido por él y su energía interna. Al suministrar una cantidad determinada de calor a un sistema, su energía interna (ΔU) será igual a la diferencia entre esa cantidad de calor y el trabajo (W) que hace el sistema sobre sus alrededores.
Es decir: Q = ΔU + W, o lo que es lo mismo: ΔU = Q – W.
Esta formulación establece que la diferencia entre la energía del sistema y el trabajo efectuado será desprendida del sistema como calor.
Ejemplo de la primera Ley de termodinámica

Imaginemos el motor de un automóvil. La gasolina es un sistema termodinámico que reacciona con el oxígeno generando una chispa que produce una combustión. Esta reacción mueve un pistón que es el responsable del movimiento de las ruedas del automóvil (trabajo). Además, todo el proceso genera calor que sale por el caño de escape.
Si pudiéramos medir la cantidad de combustible consumido, la cantidad de trabajo desempeñado y la cantidad de calor liberado, llegaríamos a la conclusión de que la energía en el motor se ha mantenido constante en el tiempo (no se creó ni destruyó energía).
Segunda ley de la termodinámica
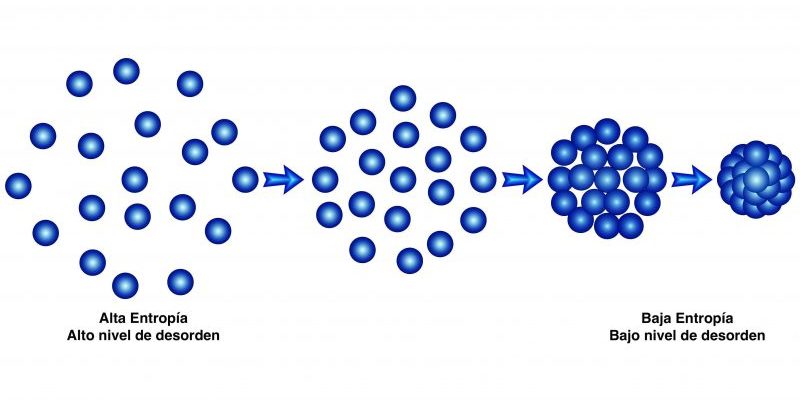
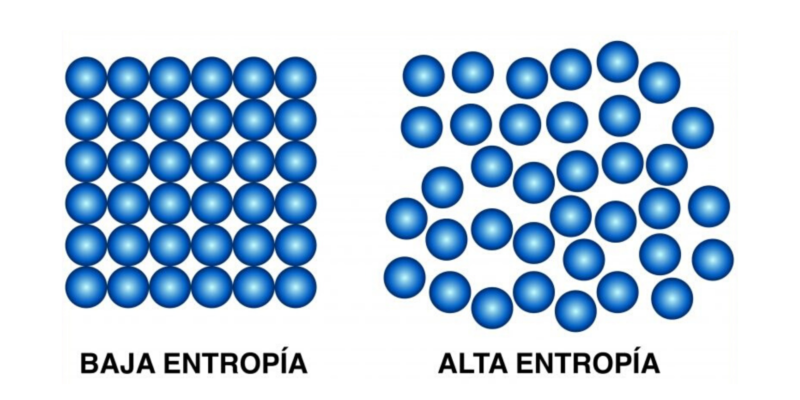
Este segundo principio establece que “la cantidad de entropía en el universo tiende a incrementarse en el tiempo”, esto es, que el desorden de todos los sistemas incrementa hasta que hayan alcanzado el equilibrio.
Dicho de otro modo: dado el tiempo suficiente, todos los sistemas tienden al equilibrio, que es el estado de máximo desorden, máxima entropía. Esta ley postula la irreversibilidad de los fenómenos físicos, e introduce la función de estado de entropía (S).
Así como la primera ley relaciona las distintas energías que intervienen en un proceso, la segunda ley impone restricciones a su dirección y un límite superior a la eficiencia de una máquina térmica. Esto quiere decir que ninguna máquina que convierte calor en trabajo puede hacerlo con 100% de eficiencia. Así, la segunda ley es importantísima para muchas aplicaciones de la vida cotidiana y para la industria.
Este principio también se formula como que el cambio en la entropía (dS) es siempre igual o mayor que la cantidad de calor transferido (Q), dividido por la temperatura (T) de la fuente que proporciona o absorbe ese calor: dS ≥ δQ / T
Ejemplo de la segunda ley de termodinámica
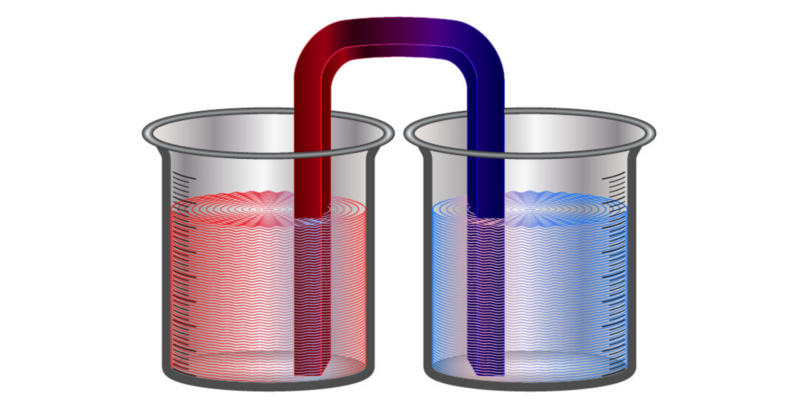
Ya que esta ley determina la irreversibilidad de los fenómenos físicos, es posible comprobarla fácilmente. Si ponemos dos cuerpos con distintas temperaturas en contacto, luego de cierto tiempo la entropía aumentará y sus temperaturas serán iguales. Si separamos los cuerpos, ambos mantendrán esas temperaturas de equilibrio y no volverán naturalmente a las originales. El proceso es irreversible.
Tercera ley de la termodinámica
Conocida también como el Postulado de Nerst, esta ley plantea que la entropía de un sistema llevado al cero absoluto es una constante definida:
- Al llegar al cero absoluto (0 K), los procesos de los sistemas físicos se detienen.
- Al llegar al cero absoluto (0 K), la entropía poseerá un valor mínimo constante.
Ejemplo de la tercera ley de termodinámica

Si bien resulta difícil alcanzar de manera cotidiana temperaturas cercanas al cero absoluto (-273,15 °C, un valor que nunca se ha logrado hasta ahora), este principio puede ejemplificarse con lo que ocurre en nuestro congelador: los alimentos que colocamos allí son llevados a temperaturas muy bajas, lo que enlentece —o incluso puede llegar a detener casi por completo— los procesos bioquímicos en su interior, retardando su descomposición y extendiendo su vida útil.
¿Por qué son importantes las leyes de termodinámica?
Estos cuatro preceptos termodinámicos describen el modo en que operan de los sistemas termodinámicos y, por lo tanto, ofrecen una guía aplicable a la comprensión, al menos teórica, de las leyes que rigen la física universal.
Son fruto de la capacidad analítica del ser humano (más que de la experimentación directa, ya que se trata de principios teóricos) y, al mismo tiempo, constituyen la base para futuros análisis y desarrollos en la materia.
Sigue con:
Referencias
- “Las leyes de la termodinámica en 5 minutos” (Video) en https://www.youtube.com/
- “Las leyes de la termodinámica” en https://es.khanacademy.org/
- “Leyes de la termodinámica” en https://geofrik.com/
- “Termodinámica” en http://www.jfinternational.com/
- “Thermodynamics” en https://www.britannica.com/




¿Te fue útil esta información?
Sí No¡Genial! Muchas gracias por visitarnos :)