Te explicamos qué son los gases ideales, su clasificación y propiedades que presentan. Además, sus características generales y para qué sirven.
¿Qué son los gases ideales?
Se denomina gas ideal a un gas hipotético o teórico, que estaría compuesto por partículas que se desplazan aleatoriamente y sin interactuar entre sí.
Su energía cinética es directamente proporcional a la temperatura. Las colisiones entre las moléculas que lo componen (entre sí y con el recipiente o contenedor) son de tipo elástico, es decir, que conservan el momento y la energía cinética.
Se trata de un concepto útil que puede ser analizado al hacer uso de la mecánica estadística, a través de una ecuación de estado simplificada que se conoce como “ley de gases ideales”.
Muchos de los gases reales conocidos en la química se comportan a temperatura y presión ambientales como un gas ideal, al menos desde una perspectiva cualitativa. Esto permite que sean estudiados como gases ideales dentro de ciertos parámetros razonables.
Sin embargo, el modelo de los gases ideales tiende a fallar cuando la temperatura es baja y la presión es alta, pues en esas condiciones la interacción de las partículas del gas es considerable y los espacios intermoleculares no se pueden considerar como un vacío.
De todas formas, este modelo no es apropiado para gases pesados como los gases refrigerantes, pero funciona bien para gases ligeros como el hidrógeno molecular (H2) y para algunos gases pesados como dióxido de carbono (CO2).
Ver además: Gases nobles
Tipos de gases ideales
Existen tres tipos básicos de gases ideales, de acuerdo al tipo de enfoque físico elegido para su planteamiento:
- Gas ideal de Maxwell-Boltzmann. A su vez puede ser: gas ideal termodinámico clásico o gas ideal cuántico, dependiendo del enfoque físico aplicado en su estudio.
- Gas ideal cuántico de Bose. Está compuesto por bosones, que son un tipo de partículas elementales. Por ejemplo: los fotones, que son partículas que portan radiación electromagnética como la luz visible, son un tipo de bosón.
- Gas ideal cuántico de Fermi. Está compuesto por fermiones, que son otro tipo de partículas elementales. Por ejemplo: los electrones, que son una de las partículas que constituyen los átomos, son un tipo de fermión.
Propiedades de los gases ideales
Algunas de las principales propiedades de los gases ideales son:
- Poseen siempre un mismo número de moléculas.
- No tienen fuerzas de atracción o repulsión entre sus moléculas.
- No pueden experimentar transiciones de fase (gas-líquido, gas-sólido).
- Las moléculas del gas ideal ocupan siempre el mismo volumen a las mismas condiciones de presión y temperatura.
Ley de los gases ideales

El estado de una cantidad de materia gaseosa se describe en base a cuatro variables distintas: presión, volumen, temperatura y número de moles de gas.
La relación matemática ideal entre dichos factores es, justamente, la ley de los gases ideales, que predice el comportamiento de la mayoría de los gases reales a temperatura y presión ambiente.
Esta ley permite calcular alguna de las cuatro variables a partir del conocimiento de las otras tres, según la ecuación que así lo expresa: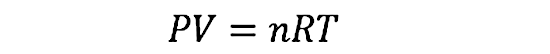
P representa la presión del gas, V su volumen, n el número de moles de gas (que debe permanecer constante), R la constante de los gases ideales (igual a 8.314472 J/molK) y T la temperatura del gas en cuestión.
Si un gas cumple con esta ley, puede tratarse como si fuera ideal.
Esta ley es, además, la combinación de las leyes de Boyle, Gay-Lussac, Charles y Avogadro.
Ley de Boyle
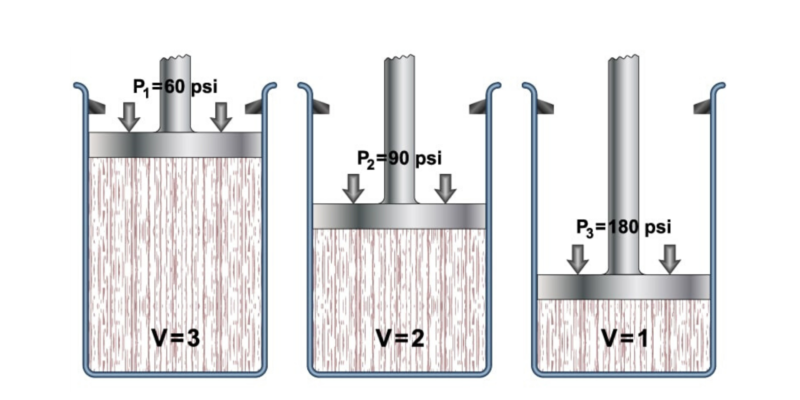
En el siglo XVII, el científico Robert Boyle llevó a cabo una serie de experiencias empleando gases y líquidos, gracias a las cuales determinó el efecto que ejerce la presión sobre el volumen en los gases.
Esto lo llevó a formular su ley, que afirma que “el volumen de un gas varía de forma inversamente proporcional a la presión si la temperatura permanece constante”.
Esto se representa para gases ideales mediante la siguiente ecuación: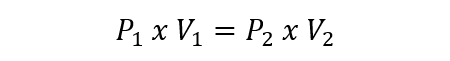
Donde P1 y V1 son la presión y el volumen inicial del gas, mientras que P2 y V2 son la presión y el volumen final.
Ley de Gay-Lussac
Esta ley explica que la presión de una masa de gas cuyo volumen se mantiene constante es directamente proporcional a la temperatura que posea (expresada en kelvin). Fue planteada por Joseph Louis Gay-Lussac en 1802.
Para los gases ideales, esta ley se representa a través de la ecuación: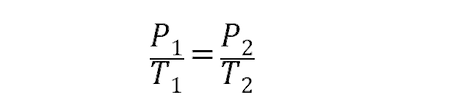
Donde P1 y T1 son la presión y la temperatura inicial del gas, mientras que P2 y T2 son la presión y la temperatura final.
Ley de Charles
Gracias a los estudios del francés Jacques Charles en 1787, tenemos esta ley que expresa la relación directamente proporcional entre la temperatura y el volumen de un gas, a cierta presión.
La ecuación que representa a esta ley es la siguiente: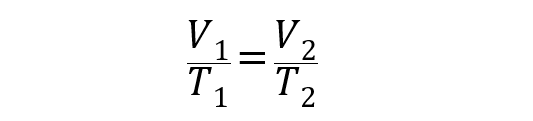
Donde V1 y T1 son el volumen y la temperatura inicial del gas, mientras que V2 y T2 son el volumen y la temperatura final.
Ley de Avogadro
Es una ley formulada en 1811 por Amadeo Avogadro, quien descubrió que:
“Volúmenes iguales de distintas sustancias gaseosas, medidos en las mismas condiciones de presión y temperatura, contienen el mismo número de moléculas”.
¿Para qué sirve el modelo de gas ideal?
La noción de gas ideal surge por la necesidad de comprender el funcionamiento de estos fluidos, ampliamente utilizados en la industria.
En lugar de crear un modelo para cada tipo de gas, se recurre a su formulación ideal, es decir, un modelo simplificado a partir del cual se puedan estudiar la mayoría de los gases.
Gases ideales y no ideales

Los gases no ideales son los gases reales, es decir, los que existen en la vida real y cuyo comportamiento no siempre se ciñe a lo que predice la ley de los gases ideales.
Esto se hace más evidente en el caso de los gases pesados, como el vapor de agua, cuyas interacciones entre moléculas son muy considerables, por lo que su comportamiento no se puede aproximar a un gas ideal. En cambio, otros gases livianos (como el hidrógeno) suelen ser más próximos a un gas ideal en condiciones normales de presión y temperatura.
Sigue con: Coloides
Referencias
- “Gas ideal” en https://es.wikipedia.org/
- “Ley de los gases ideales” en https://es.wikipedia.org/
- “Ley de los gases ideales” en http://www.areaciencias.com/
- “Ley de los gases ideales” en https://www.fisic.ch/
- “Gases ideales” en Universidad Nacional Experimental del Táchira (UNET). http://www.unet.edu.ve/

¿Te fue útil esta información?
Sí No¡Genial! Muchas gracias por visitarnos :)