Te explicamos qué son los gases, cómo se clasifican y las propiedades que presentan. Además, cuáles son sus características y ejemplos.

¿Qué son los gases?
Los gases son uno de los tres principales estados de agregación de la materia, junto con los líquidos y los sólidos. Se caracterizan por su fluidez, su capacidad de expansión y la débil fuerza de atracción entre sus partículas. Son altamente volátiles y están presentes en numerosos fenómenos de la vida cotidiana. Cuando una sustancia adopta esta forma, se dice que está en estado gaseoso.
Las sustancias líquidas o sólidas pueden ser transformadas en gas utilizando diferentes procesos. Esta transformación implica un cambio en las propiedades físicas de las sustancias, como su estado de agregación. Sin embargo no cambian sus propiedades químicas, pues las sustancias siguen teniendo la misma estructura, es decir, no ocurren rupturas de enlaces químicos ni se generan nuevas sustancias.
Los gases se encuentran en todas partes: en la masa heterogénea de gases que llamamos atmósfera y que respiramos como aire, en los gases que se generan dentro del intestino, producto de la digestión y descomposición, y en los gases inflamables con que alimentamos nuestras cocinas y hornos.
Ver además: Estados de agregación
Historia de los gases
La palabra gas fue acuñada en el siglo XVII por el científico flamenco Jan Baptista van Helmont, a partir del término latino chaos (“caos”). Eligió el nombre por el aparente grado de desorden que exhiben las moléculas de un gas. También se conocía a este estado como “estado aeriforme”, pero este término quedó en desuso.
Las primeras leyes sobre el comportamiento de los gases fueron consecuencia de su estudio intensivo a finales del mismo siglo, en especial de sus relaciones entre presión, temperatura y volumen. Esto condujo a Émile Clapeyron a formular la ley ideal para todos los gases (“Ley de los gases ideales”) en 1834.
Gas ideal y gas real
Un gas ideal es un modelo teórico que describe el comportamiento de un gas cuyas partículas no interactúan entre sí, es decir, no ejercen fuerzas de atracción ni de repulsión. En cambio, un gas real sí presenta este tipo de interacciones, lo que puede afectar su comportamiento en determinadas condiciones.
Cuanto más simple sea la fórmula química de un gas real y menor sea su reactividad, más se puede asemejar a uno ideal. Así, los gases monoatómicos, por ejemplo, el helio (He), son los que se comportan de modo más similar a los gases ideales.
Más en: Gases ideales
Leyes de los gases
Una de las leyes más utilizadas para describir el comportamiento de los gases es la Ley de los gases ideales que, a su vez, puede comprenderse como la combinación de otras leyes:
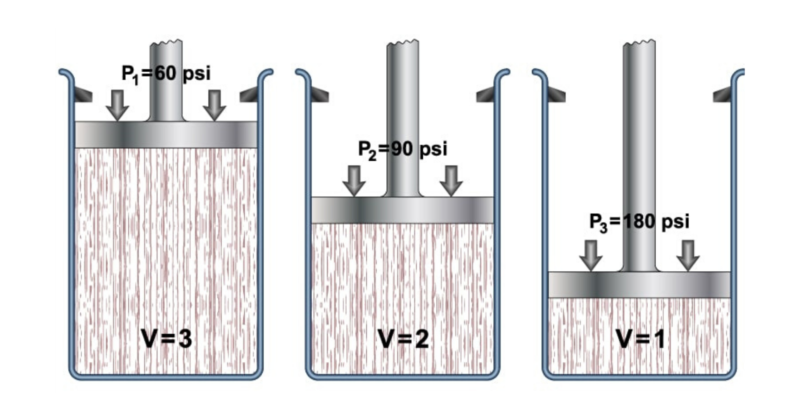
- Ley de Boyle-Mariotte. Determina que el volumen de un gas varía de forma inversamente proporcional a la presión absoluta del recipiente donde está contenido, si la temperatura permanece constante. Se expresa según la siguiente ecuación:
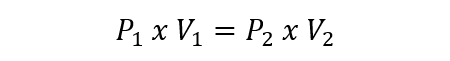
- Ley de Gay-Lussac. Explica que la presión de una masa de gas cuyo volumen se mantiene constante es directamente proporcional a su propia temperatura (expresada en grados kelvin). Esto se representa de la siguiente manera:
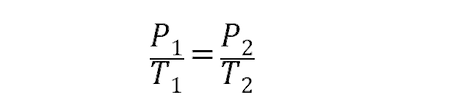
- Ley de Charles. Expresa que la temperatura y el volumen de un gas son directamente proporcionales cuando la presión es constante. Esta ley se representa mediante la siguiente ecuación:
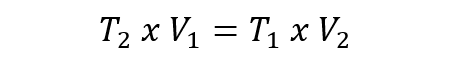
En todos los casos anteriores V1, P1 y T1 corresponden al volumen, la presión y la temperatura inicial, respectivamente. Mientras que V2, P2 y T2 corresponden al volumen, la presión y la temperatura final, respectivamente. - Ley de Avogadro. Expresa que, en iguales condiciones de presión y temperatura, volúmenes equivalentes de diferentes gases contienen el mismo número de moléculas.
- Ley de los Gases Ideales. Resulta de la combinación de las leyes de Boyle, Charles, Gay-Lussac y Avogadro, y se expresa mediante la siguiente ecuación:
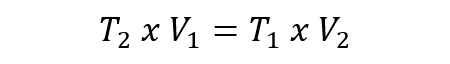
Donde P, V y T corresponden a la presión, el volumen y la temperatura, respectivamente; n es el número de moles del gas y R es la constante de los gases ideales, cuyo valor es 8,31451 J/mol·K.
Tipos de gases
Los gases pueden clasificarse según su naturaleza química en los siguientes tipos:
- Combustibles o inflamables. Son aquellos gases que pueden arder, esto es, generar reacciones explosivas o exotérmicas en presencia del oxígeno u otros oxidantes.
- Corrosivos. Son aquellos gases que, al entrar en contacto con otras sustancias, las someten a procesos de reducción u oxidación intensos, generando daños en su superficie o heridas en caso de ser materia orgánica.
- Comburentes. Son aquellos gases que permiten mantener viva una llama o una reacción inflamable, ya que inducen la combustión en otras sustancias.
- Tóxicos. Son aquellos gases que representan un peligro para la salud por las reacciones que introducen en el cuerpo de los seres vivos, como los gases radiactivos.
- Inertes o nobles. Son aquellos gases que presentan poca o nula reactividad, excepto en situaciones y condiciones determinadas.
Propiedades de los gases

Los gases presentan las siguientes propiedades:
- No tienen forma ni volumen definidos. Los gases adoptan la forma y volumen según el recipiente que los contiene.
- Pueden dilatarse y contraerse. Al igual que los sólidos y los líquidos, los gases se dilatan si se les aumenta su temperatura, y se contraen si se enfrían.
- Tienen gran fluidez. Los gases fluyen mucho más que los líquidos debido a que sus partículas tienen menor interacción. Pueden fácilmente desplazarse a través de un orificio de un recipiente a otro.
- Tienen alta difusión. Los gases pueden mezclarse fácilmente entre sí debido al gran movimiento que tienen sus partículas.
- Solubilidad. Los gases pueden ser solubles en agua o en otros líquidos.
- Se pueden comprimir. Los gases son compresibles porque sus partículas están muy separadas entre sí. Al aplicar presión, disminuye el espacio entre ellas, reduciendo así el volumen del gas.
Cambios de estados de los gases

Los gases pueden cambiar de estado según ciertas condiciones de temperatura y presión. A continuación, se describen los principales procesos físicos en los que intervienen:
- Sublimación. Es un proceso físico de cambio de fase en el que una sustancia pasa directamente del estado sólido al gaseoso, sin atravesar el estado líquido. Es un fenómeno poco común que suele producirse bajo condiciones específicas de presión y temperatura. Un ejemplo observable es el del hielo seco (dióxido de carbono sólido) a temperatura ambiente: al sublimarse, libera gas y genera una nube visible por el enfriamiento del aire circundante.
- Ebullición. Es el proceso físico mediante el cual un líquido pasa al estado gaseoso cuando alcanza su punto de ebullición. A diferencia de la evaporación, que ocurre solo en la superficie, la ebullición se produce en toda la masa del líquido.
- Evaporación. Es un proceso físico de cambio de fase en el que un líquido se convierte en gas de forma gradual y a temperaturas inferiores a su punto de ebullición. Ocurre únicamente en la superficie del líquido y es un fenómeno común en la vida cotidiana. Un ejemplo es en la ducha cuando el agua muy caliente se convierte en vapor observable como una nube blanquecina.
- Condensación. Es el proceso físico opuesto a la evaporación, mediante el cual una sustancia pasa del estado gaseoso al líquido como resultado de la pérdida de calor. Esta disminución de la energía reduce el movimiento de las partículas, lo que permite que se aproximen y formen enlaces más fuertes. Es observable, por ejemplo, en las gotas que se forman sobre un vidrio frío en un día lluvioso o en el rocío que se deposita sobre las plantas por la mañana.
- Sublimación inversa. Es el proceso físico opuesto de la sublimación, en el que una sustancia pasa directamente del estado gaseoso al estado sólido, sin atravesar la fase líquida. Este proceso requiere de condiciones de presión y temperatura muy específicas, y puede observarse, por ejemplo, en la formación de escarcha sobre superficies frías.
Plasma

El estado plasmático de la materia es considerado un cuarto estado de agregación, pero presenta similitudes con el estado gaseoso, ya que consiste en un gas ionizado. Esto significa que sus partículas han perdido o ganado electrones, lo que les confiere una carga eléctrica y permite que el plasma responda a campos electromagnéticos. Existen plasmas fríos, como los empleados en las lámparas de “lava”, y plasmas calientes, como el fuego que rodea al Sol.
Ejemplos de gases
Algunos ejemplos de gases son:
- Hidrógeno (H2). Es el gas diatómico más común del universo.
- Helio (He). Insípido, incoloro e inerte, es el menos soluble en agua de todos los gases.
- Metano (CH4). Es un hidrocarburo gaseoso de olor desagradable que se obtiene como producto de la descomposición de la materia orgánica.
- Aire. Es la mezcla heterogénea de hidrógeno, nitrógeno, oxígeno, argón y otros gases que respiramos los seres vivos.
Sigue con:
Referencias
- “Los gases y sus características” https://quimica.laguia2000.com/
- “Propiedades de los gases” https://www.portaleducativo.net/
- “Conceito e características dos gases” https://mundoeducacao.bol.uol.com.br/
- “Gas (state of matter)” https://www.britannica.com/





¿Te fue útil esta información?
Sí No¡Genial! Muchas gracias por visitarnos :)