Te explicamos qué es un enlace químico y los tipos que existen. Además, cuáles son sus características principales y algunos ejemplos.
¿Qué es un enlace químico?
Se llama enlace químico a la combinación entre átomos, moléculas o iones que forman compuestos más complejos y dotados de estabilidad, alterando sus propiedades físicas y químicas. Una vez unidos, dos o más átomos constituyen un compuesto químico.
Los átomos tienden a juntarse para alcanzar condiciones más estables que en solitario, complementando sus cargas eléctricas a través de la compartición de electrones de su órbita atómica más externa, así como también cediendo o aceptando electrones para formar iones (positivos o negativos) que luego se atraen electrostáticamente entre sí.
Esto se debe a que los protones en el núcleo atómico poseen carga positiva y los electrones alrededor carga negativa, por lo que los átomos tienden a configurarse de la manera más neutra posible.
Existen distintos tipos de enlace químico, dependiendo del tipo de átomos enlazados, que poseen mecanismos propios y peculiares para enlazarse: hasta ahora se conocen y aceptan los enlaces covalentes, iónicos y metálicos pero existen otras teorías y aproximaciones.
Ver además: Alquenos
Tipos de enlace químico
Existen tres tipos principales de enlace químico:
- Enlace covalente. Ocurre cuando átomos no metálicos de electronegatividades semejantes (por lo general, altas) se juntan para compartir electrones de su última órbita y formar un compuesto químico estable.
- Enlace iónico. Consiste en la unión de átomos metálicos y no metálicos, a través de una transferencia de electrones del metal al no metal. Así se forman iones cargados eléctricamente, cationes (+) y aniones (-), que se atraen electrostáticamente entre sí constituyendo el enlace y formando los distintos compuestos químicos iónicos. Los átomos que forman este tipo de enlace tienen una gran diferencia de electronegatividad.
- Enlace metálico. Es el que se da entre los átomos metálicos de un mismo elemento en su estado sólido, que constituyen estructuras sumamente compactas y estrechas entre sí. Es un enlace primario y fuerte, en el que los núcleos atómicos se juntan entre sí rodeados de sus electrones como en una nube.
Características de un enlace químico
Polaridad
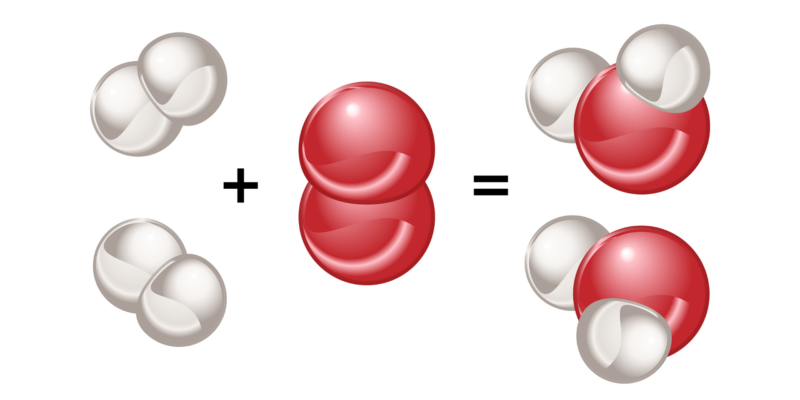
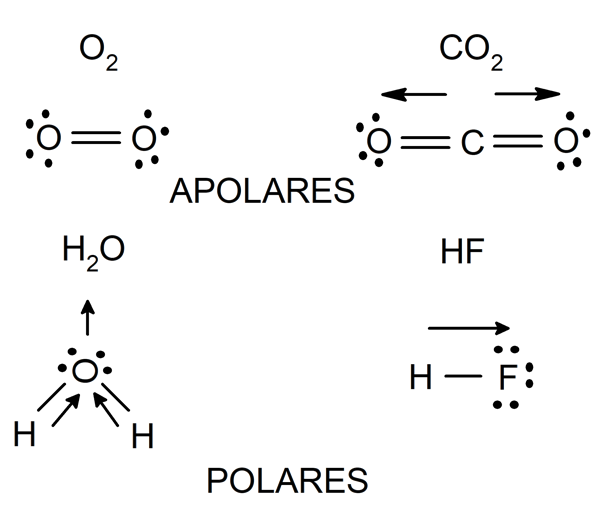
La polaridad es una característica de las moléculas formadas por enlaces covalentes, y depende directamente de la naturaleza de los átomos enlazados.
Si se enlazan dos átomos del mismo elemento, no habrá diferencia alguna entre la electronegatividad de cada uno. De esta forma, el par de electrones que comparten será atraído por cada uno de estos átomos con la misma fuerza, por lo que la distribución de cargas eléctricas será uniforme en la molécula que formen.
Lo mismo sucede cuando se enlazan átomos de distintos elementos, pero cuya diferencia de electronegatividad es muy pequeña (menor que 0.4). Las moléculas formadas de esta forma se llaman ‘no polares o apolares’ y a este tipo de enlace ‘enlace covalente apolar’.
En cambio, si se enlazan dos átomos de distintos elementos, y la diferencia de electronegatividad entre ambos es mayor que 0.4, entonces el átomo más electronegativo atrae hacia sí con mayor fuerza los electrones del enlace, generado una distribución de carga no uniforme en la estructura de la molécula que formen. Las moléculas formadas por este proceso se llaman ‘polares’ y a este tipo de enlace ‘enlace covalente polar’.
Electrovalencia
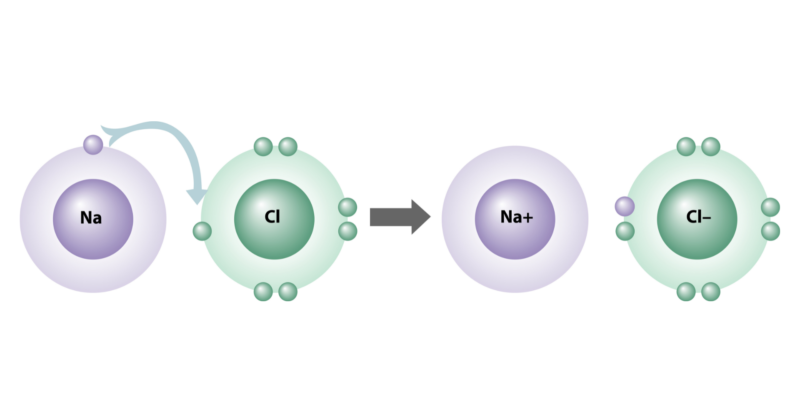
Los enlaces iónicos se caracterizan porque sus átomos tienen una gran diferencia de electronegatividad (mayor que 2), en la medida en que uno pierde y el otro recibe electrones al juntarse.
A dicha capacidad eléctrica en los átomos se la conoce como electrovalencia, dado que algunos elementos son más susceptibles naturalmente de ser “dadores” de electrones (grupos IA, IIA, IIIA de la tabla periódica) y otros suelen ser, en cambio, “aceptores” (grupos VA, VIA y VIIA).
Mar de electrones
Se llama “mar de electrones” al fenómeno que se produce entre los átomos metálicos de un mismo tipo que se hallan sometidos entre sí a enlaces metálicos. Se puede ver como si los núcleos atómicos estuviesen inmersos en un mar de sus electrones.
Los metales poseen baja electronegatividad, presentan brillo y son maleables, condiciones que se deben a la naturaleza del enlace que los mantiene unidos en su estado sólido: un orden rígido que desplaza a los electrones de valencia de sus orbitales, permitiendo una gran conducción de la electricidad y el calor, y la capacidad de devolver casi la totalidad de la luz que los impacta.
Ruptura de enlaces químicos

Los enlaces químicos pueden romperse en condiciones determinadas, al ser sometidos a la acción del calor, de la electricidad o de otras sustancias que rompan la unión y permitan la liberación de sus átomos involucrados.
Así, por ejemplo, al aplicar electricidad al agua pueden separarse el hidrógeno y oxígeno que la componen en un proceso llamado “electrólisis”. Por otro lado, al aumentar mucho la temperatura (suministrando calor) de una proteína, se la puede desnaturalizar y romper sus enlaces constitutivos.
Puentes de hidrógeno
Un puente de hidrógeno es la unión de un átomo electronegativo con otro de hidrógeno que está, a su vez, unido covalentemente a otro átomo electronegativo, formando un “puente” entre dos átomos que normalmente no podrían juntarse.
Se trata, sin embargo, de un tipo de enlace de fuerza débil, pero que permite la composición de moléculas complejas dotándolas de gran estabilidad, tanto en sustancias orgánicas como inorgánicas.
También existen enlaces por puentes de hidrógeno entre distintas moléculas de un mismo compuesto químico. Por ejemplo, las moléculas de agua forman puentes de hidrógeno entre los átomos de oxígeno y los de hidrógeno.
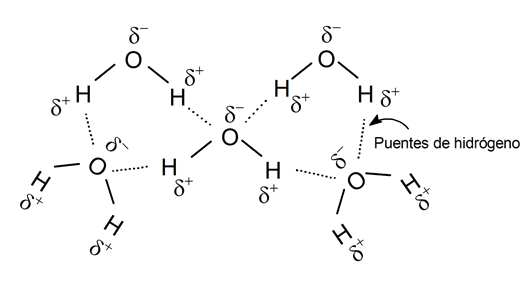
Enlaces dobles y triples
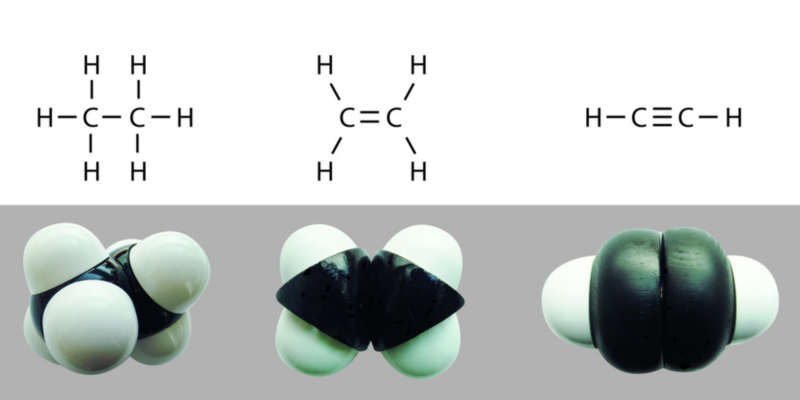
Los enlaces covalentes pueden ser simples, dobles o triples, dependiendo de la cantidad de pares electrónicos compartidos entre los átomos que los componen. Mientras más electrones se compartan, más fuerte será el enlace y más energía costará romperlo.
Los enlaces simples se representan gráficamente con una sola línea A-A, los dobles con dos A=A y los triples con tres A≡A.
Ejemplos de compuestos con enlaces covalentes
El enlace covalente es sumamente común en el mundo de la química orgánica. Por ejemplo, está presente en sustancias como:
- Benceno (C6H6)
- Metano (CH4)
- Glucosa (C6H12O6)
- Amoníaco (NH3)
- Clorofluorocarburos (“Freón”) (CFC)
- Diamantes, grafitos y otras formas del carbono (C)
Ejemplos de compuestos con enlaces iónicos
Numerosas sustancias presentan enlaces iónicos en sus compuestos, como:
- Óxido de magnesio (MgO)
- Sulfato de cobre (II) (CuSO4)
- Ioduro de potasio (KI)
- Cloruro de manganeso (MnCl2)
- Carbonato de calcio (CaCO3)
- Sulfuro de hierro (III) (Fe2S3)
Origen del concepto

Desde tiempos remotos se sospecha que los elementos constitutivos de la materia se agrupan entre sí de acuerdo a ciertas formas de afinidad. Pero fue sería en 1704 cuando Isaac Newton postularía su teoría del enlace químico, basándose en las teorías atómicas ya formuladas, y advirtiendo que “una fuerza” mantenía a los átomos unidos en las reacciones químicas observadas.
En 1819, gracias a la invención de la pila voltaica, Jöns Jakob Berzelius introdujo las nociones de electropositividad y electronegatividad a la teoría de la combinación atómica, y posteriormente, en el siglo XX, Gilbert Lewis introdujo el concepto del enlace formado por par de electrones, dando origen a la posibilidad de enlaces simples, dobles y triples, ya que los átomos podrían compartir entre uno y seis electrones. Así surgieron los enlaces covalentes.
En 1927 surgió también una teoría semejante a la de Lewis, pero en la que ocurría una transferencia total de electrones, y fue propuesta por Walther Kossel. Esta daría origen a los enlaces iónicos.
Sigue con: Fuerzas intermoleculares
Referencias:
- "Química" Dr. Aurelio Beltrán. Facultad de Química de la Universidad de Valencia. Editorial Reverté S. A. 1990. ISBN: 84-291-7183-5
- "Química 1" Pascual de Anda Cárdenas. Editorial Umbral. 2006. ISBN: 970-9758-29-2
- "Química" 9na edición. Raymond Chang. 2007. ISBN-13: 978-0-07-298060-8
- "Enlace Químico" en Wikipedia.
¿Te fue útil esta información?
Sí No¡Genial! Muchas gracias por visitarnos :)