Índice
Te explicamos qué es el carbono, por qué es tan importante este elemento para la vida y cuáles son sus características principales.

¿Qué es el átomo de carbono?
El carbono es uno de los elementos más abundantes en la Tierra, esencial para la vida. Es el componente principal de la materia orgánica; también integra el producto final del metabolismo de la mayoría de los seres vivos y del proceso de combustión al formar parte del dióxido de carbono (CO2).
El carbono se presenta bajo numerosas estructuras y también de manera amorfa; sus propiedades físicas son a menudo muy contrastantes. Tiene la propiedad de poder combinarse con casi todos los elementos; se puede combinar tanto con metales como con no metales (ejemplos: carburo de calcio (CaC2), disulfuro de carbono (CS2), cloroformo (CHCl3), etc.).
Se calculan aproximadamente unos 10 millones de compuestos de carbono, muchos de ellos esenciales para la vida en el planeta.
Características del átomo del carbono
- Su número atómico es 6 y su masa atómica es 12. Esto significa que tiene en su núcleo 6 protones y 6 neutrones en su configuración estable, y que el núcleo está rodeado por 6 electrones. Esos electrones se distribuyen según la siguiente configuración electrónica: dos en su primer nivel de energía (que tiene un orbital s) y cuatro en su segundo nivel de energía (que tiene los orbitales s y p), esto se representa como 1s22s22p2.
- Es tetravelente. Esto significa que tiene 4 electrones orbitando en su último nivel de energía, que se pueden combinar con los electrones más externos de otros átomos, a menudo también de carbono, formando enlaces covalentes. Esto significa que el carbono puede formar cuatro enlaces químicos.
- Presenta alotropía. Puede presentarse bajo estructuras moleculares diferentes, en el mismo estado físico, dependiendo de las condiciones de formación. Los alótropos más importantes del carbono son: diamante, grafito, lonsdaleíta, fullereno, nanotubo de carbono, carbono amorfo y grafeno.
- Presenta isótopos. El carbono tiene solo dos isótopos naturales: el carbono-12, que es el mayoritario (98,90 %), y el carbono-13, presente en mínima proporción (1,10 %). Además existen trece isótopos inestables cuyos períodos de semidesintegración o vida media van desde los 200 nanosegundos (como en el carbono-22) hasta los 5730 años (como sucede con el carbono-14). El carbono-13 se utiliza en estudios estructurales (sobre todo, de RMN/Resonancia Magnética Nuclear), el carbono-14 se emplea para datar objetos arqueológicos, dada su larguísima vida media.
- Se combina fácilmente. El carbono se puede combinar tanto con metales como con no metales (por ejemplo: carburo de calcio (CaC2), disulfuro de carbono (CS2), cloroformo (CHCl3), etc.). Se estima que hay cerca de 10 millones de compuestos de carbono, muchos de ellos esenciales para la vida.
Hibridaciones del carbono
Los orbitales atómicos son las probabilidades de encontrar un electrón en una región del espacio alrededor del núcleo atómico. La hibridación es la interacción entre estos orbitales, que cuando se superponen forman orbitales híbridos que llevan a la formación de los distintos enlaces químicos.
En el caso del carbono, sus cuatro electrones de la capa más externa se pueden combinar con los electrones de otros átomos, así, el átomo de carbono puede formar tres tipos de hibridaciones, que tienen implicancias en la geometría molecular final de los compuestos que forma el carbono. Estas hibridaciones pueden ser:
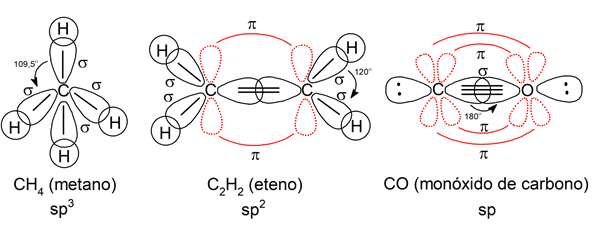
- Hibridación sp3. Explica la formación y geometría de los compuestos con enlaces simples, que tienen una geometría en forma de tetraedro.
- Hibridación sp2. Explica la formación y geometría de los compuestos con enlaces dobles, que pueden tener geometría trigonal plana.
- Hibridación sp. Explica la formación y geometría de los compuestos con enlaces triples, que tienen geometría lineal.
Tres posibles configuraciones

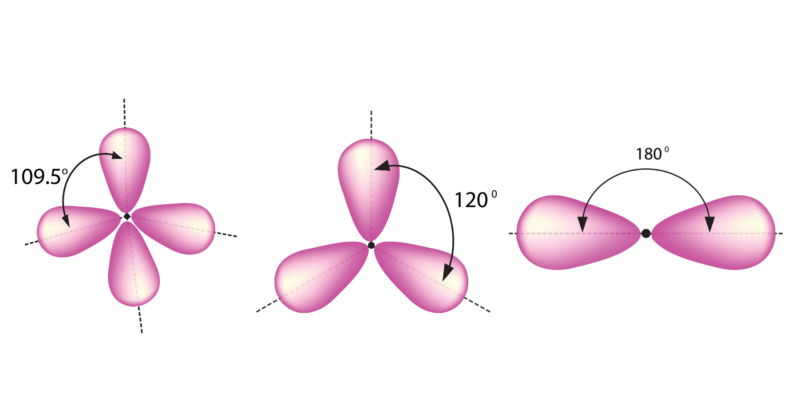
Dado que el tipo de unión (determinado por el tipo de hibridación) determina el ángulo de enlace, a su vez existen tres posibles geometrías moleculares cuando el carbono participa en la formación de un enlace químico:
- El enlace simple determina la formación de un tetraedro, con ángulos de 109.5°.
- El enlace doble determina la formación de una estructura triangular plana, con ángulos de 120°.
- El enlace triple determina la formación de una estructura lineal, con ángulos de 180°.
Reactividad del carbono
- Los compuestos formados por carbono que tienen enlaces múltiples (dobles o triples) entre los átomos de carbono son más reactivos que los que tienen enlaces simples.
- El carbono reacciona con hidrógeno para formar hidrocarburos.
- Es combustible.
- El carbono reacciona con el oxígeno para formar principalmente dióxido de carbono (CO2) y monóxido de carbono (CO).
Relativa semejanza con el silicio
El carbono es el primer miembro del grupo IVA dentro de la Tabla Periódica de los elementos. Le sigue en este mismo grupo el silicio (Si), que también tiene 4 electrones en su capa más externa, pero en un nivel de energía superior.
Sin embargo, el silicio no puede formar enlaces múltiples silicio-silicio a causa de la repulsión que genera un mayor número de electrones internos, lo que hace que los átomos no puedan aproximarse lo suficiente. Por otra parte, ambos elementos son no metales y son sólidos a temperatura ambiente.
Kekulé y las bases de la química orgánica
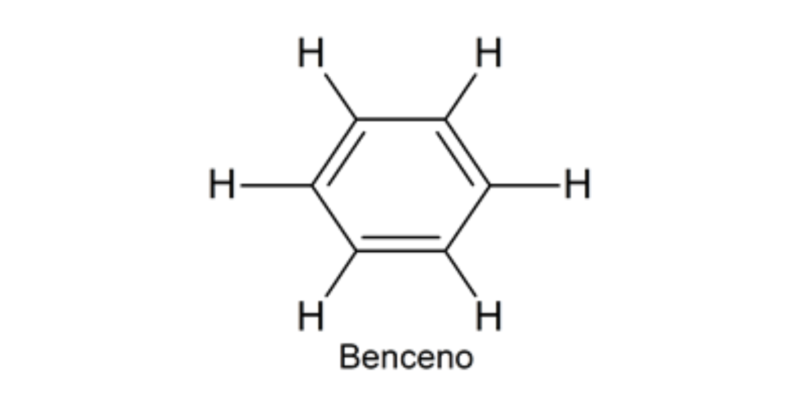
El químico alemán August Kekulé postuló en el año 1858 una teoría estructural que permitió explicar el fenómeno de resonancia del benceno. Propuso que el benceno está constituido por 6 átomos de carbono y 6 de hidrógeno, pero los átomos de carbono están organizados en forma de ciclo y los enlaces entre ellos se alternan entre simples y dobles. Esto fue fundamental como antecedente del concepto de enlace covalente introducido por Lewis, que sirve de base para entender la química del carbono en general.
Sigue con:



¿Te fue útil esta información?
Sí No¡Genial! Gracias por visitarnos :)