Índice
Te explicamos qué son los alquenos y las propiedades físicas y químicas que presentan. Además, cuáles son sus características y ejemplos.

¿Qué son los alquenos?
Se conoce como alquenos a un tipo de hidrocarburos insaturados (que han perdido hidrógenos enlazados a átomos de carbono adyacentes) en cuyas moléculas es posible encontrar enlaces dobles carbono-carbono.
Los alquenos o compuestos olefínicos son sustancias orgánicas que, junto a los alcanos (o parafinas), los alquinos (o compuestos acetilénicos) y los cicloalcanos, constituyen los hidrocarburos alifáticos, es decir, aquellos que no son aromáticos (derivados principalmente del benceno/C6H6).
A su vez, los hidrocarburos alifáticos pueden clasificarse en lineales, monocíclicos (un solo anillo compuesto de átomos de carbono) y policíclicos (con varios anillos enlazados), así que puede haber alquenos pertenecientes a todas las clasificaciones.
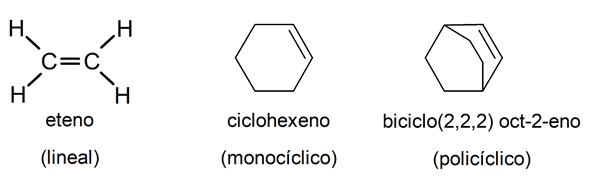
Nomenclatura de los alquenos
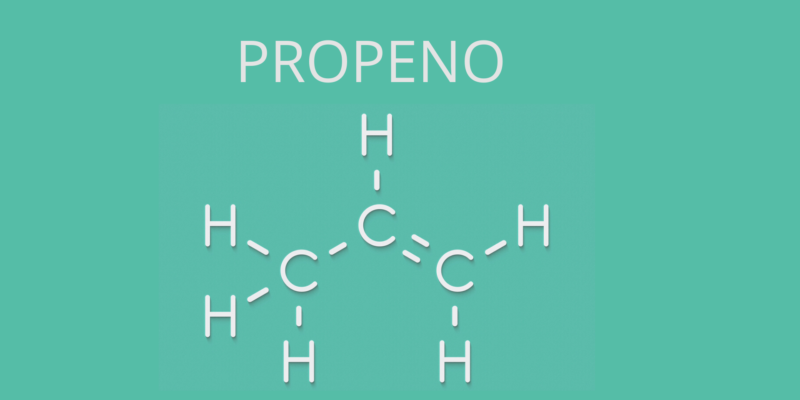
Los alquenos se llamaban antiguamente “olefinas” debido a que sus representantes más simples, como el eteno, se hacían reaccionar con halógenos para producir óleos.
Según la nomenclatura sistemática estos compuestos se nombran usando la misma regla que para los alcanos. Se busca la cadena carbonada más larga que contiene el doble enlace. En caso de tener más de un doble enlace, se busca la cadena que tiene la menor combinación de las posiciones de estos dobles enlaces. Si la molécula tiene sustituyentes, se nombran poniéndoles el prefijo numérico que corresponde a la posición del carbono al que están enlazados (1,2,3…), pero si tiene varios sustituyentes iguales, además se pone el prefijo (di, tri, tetra..) según sean dos, tres o cuatro.
Sin embargo, muchos alquenos se conocen por su nombre no sistemático (como suele ocurrir con los hidrocarburos) y en ese caso se sustituye la terminación oficial (–eno) por –ileno, como ocurre con el eteno, llamado también etileno, o con el propeno, llamado propileno.
Por otro lado, de existir más de un enlace doble, se emplean respectivamente las terminaciones –dieno (dos dobles enlaces) o –trieno (tres dobles enlaces), etc.
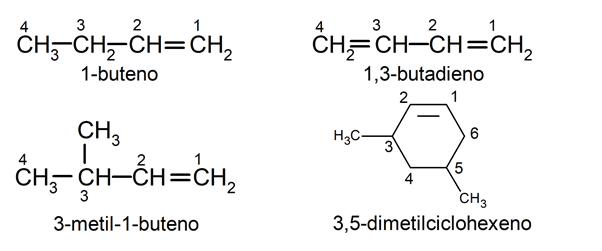
Fórmula general de los alquenos
La fórmula general de los alquenos lineales es CnH2n, en la que n representa la cantidad de los átomos de carbono respectivos. Esto significa que por cada doble enlace nuevo habrá dos átomos de hidrógeno menos que los indicados en esta fórmula.
Diferencia con los alcanos y alquinos

Los alquenos se diferencian de los alcanos y alquinos en el enlace doble que aparece entre sus átomos de carbono. Suele decirse, de hecho, que un alqueno es un alcano que ha perdido átomos de hidrógeno, liberando así dos electrones que conforman el segundo enlace de cada enlace doble.
Los alcanos presentan un enlace simple entre sus carbonos (C-C); los alquenos al menos un enlace doble (C=C) y los alquinos al menos un enlace triple (C≡C).
Propiedades físicas de los alquenos
Los alquenos presentan las siguientes propiedades físicas:
- Dependiendo de su cantidad de átomos de carbono, los alquenos pueden ser gases (menos átomos) o líquidos (más átomos).
- Son insolubles en agua pero solubles en éter, cloroformo o benceno.
- Son menos densos que el agua.
- Presentan cierta polaridad molecular o ninguna dependiendo de la geometría de cada molécula alrededor del doble enlace.
- Tienen una mayor acidez que los alcanos correspondientes, producto de la polaridad del enlace.
- Su punto de ebullición y de fusión no varía mucho respecto a los alcanos correspondientes.
Propiedades químicas de los alquenos

Los alquenos se caracterizan por una elevada reactividad química respecto a los alcanos y sus reacciones mayoritarias son de adición. Las reacciones más frecuentes son:
- Adición de haluros de hidrógeno. Reacción con HCl o HBr.

- Halogenación. Reacción con halógenos (Cl2, Br2).

- Polimerización. Vital en la industria del petróleo y sus derivados, ya que se logran largas y resistentes cadenas de materia maleable (plásticos).

Abundancia de los alquenos
Los alquenos son bastante menos abundantes que los alcanos, de hecho se los encuentra en el petróleo natural pero como un componente muy minoritario.
Los procesos de “cracking” petrolero, en cambio, son una fuente importante de alquenos aprovechables para la industria. Sin embargo, los alquenos son comunes en la química orgánica y forman parte de las reacciones comunes a seres vivos, en especial plantas y vegetales.
Síntesis de alquenos
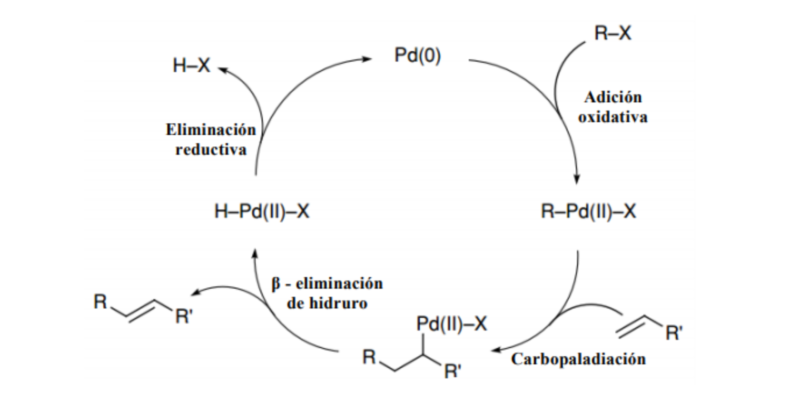
Las reacciones que arrojan alquenos como resultado y que, por lo tanto, pueden emplearse para sintetizarlos son:
Deshidrohalogenación
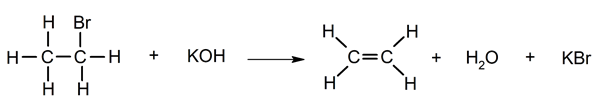
Deshalogenación
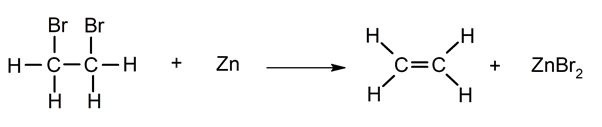
Eliminación de agua a partir de alcoholes.
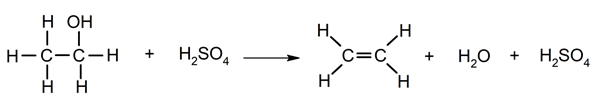
Pirólisis
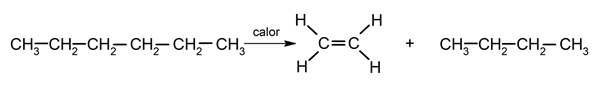
También pueden obtenerse como resultado de la reacción de Chungaev y la reacción de Grieco, mediante formación de enlaces carbono-carbono (Reacción de Wittig, Olefinación de Julia, etc.), por reacciones pericíclicas o reacciones de acoplamiento con metales (Reacción de Suzuki, Reacción de Heck).
Dienos y polienos
En caso de haber más de un enlace doble en la molécula, estaremos en presencia de un dieno (dos enlaces), un trieno (tres enlaces) o un polieno (múltiples enlaces).
Estos compuestos, sin embargo, carecen de propiedades especiales y se comportan como alquenos normales, excepto que presentan reactividades muy particulares, dependiendo de la ubicación en la molécula de los múltiples enlaces dobles.
Estabilidad de los alquenos
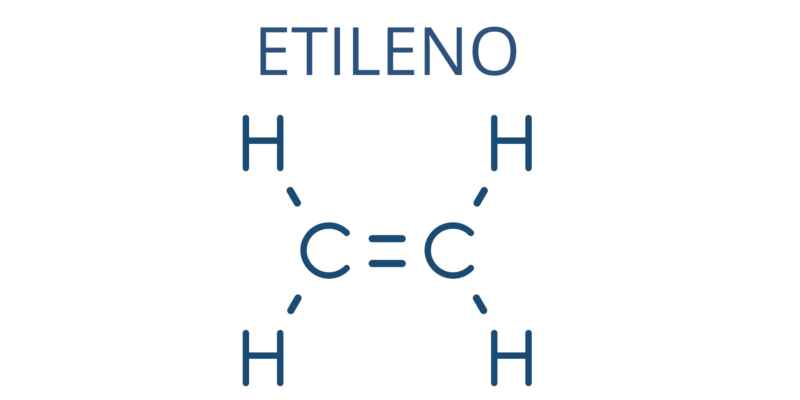
Los alquenos son más o menos estables, dependiendo del lugar de la molécula donde esté ubicado el enlace doble. Los alquenos internos, cuyo doble enlace está ubicado hacia la parte central de la molécula, son mucho más estables que los que tienen el doble enlace ubicado en los extremos. De esta forma, los isómeros trans son más estables que los cis.
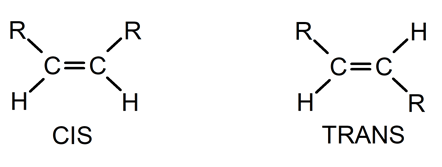
Ejemplos de alquenos
Algunos alquenos comunes son:
- Eteno (CH2=CH2)
- Propeno (CH2=CH-CH3)
- 1-buteno (CH2=CH-CH2-CH3)
- Colesterol (C27H46O6)
- Lanosterol (C30H50O)
- Alcanfor (C10H16O)
- Mirceno (C10H16)
Sigue con:
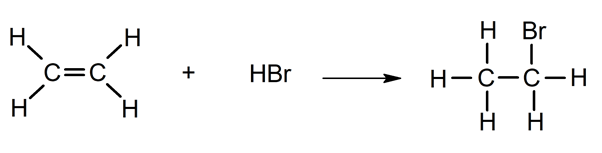
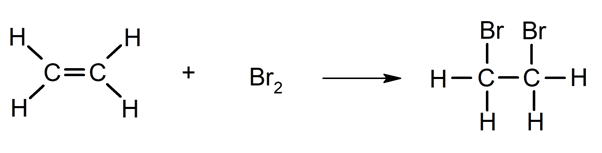



¿Te fue útil esta información?
Sí No¡Genial! Gracias por visitarnos :)